ENTE
COSTARRICENSE DE ACREDITACIÓN
AVISOS
El Ente Costarricense de Acreditación ( ECA ), da a conocer la
modificación del documento código ECA
-MC-P17 Criterios para la Participación en Ensayos/ Pruebas de Aptitud y Otras
Comparaciones, emitido el 25 de mayo del 2012, de la siguiente manera:
La Gerencia del Ente Costarricense de Acreditación ( ECA ) informa que
se ha modificado del Procedimiento ECA
-MC-P17 Criterios para la Participación en Ensayos/ Pruebas de Aptitud y Otras
Comparaciones Versión 02, el cual deja sin efecto el anterior
procedimiento: ECA -MC-P17 Política y
Criterios para la Participación en Ensayos/Pruebas de Aptitud y Otras
Comparaciones para los Laboratorios Versión 01-
El Procedimiento ECA -MC-P17 Criterios para la Participación
en Ensayos/Pruebas de Aptitud y Otras Comparaciones Versión 02 se encontrará a
disposición de los interesados en nuestra página electrónica www.eca.or.cr/
http://www.eca.or.cr/docs.php; así mismo podrán solicitar gratuitamente una
copia no controlada en la Gestoría de Calidad de las oficinas centrales
del ECA ubicadas en Rohrmoser
150 metros al este del centro comercial Plaza Mayor, contiguo a Prisma Dental,
de lunes a viernes de las 8 a las 16 horas. Entra en vigencia a partir de esta
publicación en el Diario Oficial La Gaceta.-San José, 25 de mayo del 2012.-
(Nota
de Sinalevi: El presente procedimiento se extrajo
del sitio Web del Ente Costarricense de
Acreditación, y se transcribe a continuación:)
(Nota
de Sinalevi: El presente procedimiento fue reformado
parcialmente y reproducido su texto de forma íntegra mediante publicación en La
Gaceta N° 75 del 30 de abril del 2018, donde se actualiza la versión 06 y se
publica la versión 07 que se reproduce a continuación:)

TABLA DE CONTENIDO
1. INTRODUCCIÓN
....................................................................................................................
1
2. OBJETIVO
..............................................................................................................................
2
3. ALCANCE
...............................................................................................................................
2
4. DEFINICIONES
.......................................................................................................................
2
5. CRITERIOS GENERALES
......................................................................................................
4
6 REQUISITOS ESPECIFICOS
.................................................................................................
5
7 PLAN DE PARTICIPACIÓN EN
INTERCOMPARACIONES .................................................. 11
8 MONITOREO DEL DESEMPEÑO EN
INTERCOMPARACIONES ........................................ 12
9 CRITERIOS ESPECÍFICOS PARA LA
EVALUACIÓN DE PROVEEDORES DE ENSAYOS/ PRUEBAS DE APTITUD Y OTRAS COMPARACIONES
PARA LOS LABORATORIOS Y ORGANISMOS DE INSPECCIÓN (cuando sea relevante para el
caso de organismos de inspección)
.....................................................................................................................................
14
10 BIBLIOGRAFIA
.....................................................................................................................
15
11 ANEXO
................................................................................................................................
15
12 IDENTIFICACIÓN DE CAMBIOS
..........................................................................................
24
1. INTRODUCCIÓN
Los laboratorios y los
organismos de inspección (para estos últimos cuando sea relevante), deben
poseer formas para demostrar la validez de los ensayos, calibraciones e inspecciones
que realizan como parte de su control de calidad y ECA, como Organismo de
Acreditación, está en la obligación de velar por su cumplimiento. De allí
radica la importancia de participar en actividades de ensayo de aptitud u otras
comparaciones, para asegurar la calidad de los resultados y demostrar la
competencia técnica, convirtiéndose en una herramienta útil, tanto para el
propio laboratorio u organismo de inspección, como para el ECA.
ILAC, establece que con el fin
de obtener y mantener los acuerdos de reconocimiento mutuo entre los sistemas
de Acreditación de laboratorios, es necesario que ECA, establezca los
lineamientos para la participación de los laboratorios y organismos de
inspección acreditados o en proceso de Acreditación; así como las
responsabilidades de los laboratorios y organismos de inspección, evaluadores y
del propio ECA para asegurar las buenas prácticas en el uso de programas de
ensayos de aptitud organizados en el ámbito nacional, regional o internacional.
2. OBJETIVO
Establecer los
criterios para la participación en ensayos/pruebas de aptitud y otras
comparaciones interlaboratorios para laboratorios y
organismos de inspección.
3. ALCANCE
Este documento
debe ser aplicado por:
− Los laboratorios
acreditados o en proceso de Acreditación ante el ECA.
− Los
organismos de inspección acreditados o en proceso de Acreditación ante el ECA,
cuando sea relevante, pues se reconoce que los ensayos de aptitud no son un
elemento usual y esperado en los procesos de acreditación de la mayoría de los
tipos de inspección. Sin embargo, los ensayos de aptitud se pueden utilizar en
algunos tipos de inspección cuando estén disponibles y justificado por la
inclusión de las actividades de prueba o mediciones que afectan directamente y
determinan el resultado de la inspección o cuando sea requerido por la ley o
por los reguladores.
− Los
proveedores de ensayos de aptitud acreditados o en proceso de acreditación ante
el ECA. Para el caso de proveedores de ensayos de aptitud, la aplicación de la
presente política se realiza de acuerdo a lo establecido en el ECA-MC-C15 de
criterios para evaluación y acreditación de proveedores de ensayos de aptitud.
− Los
evaluadores y expertos técnicos que participan en los procesos de Acreditación.
− Los
miembros de Órganos Colegiados que intervengan en el proceso de Acreditación.
4.1
Comparaciones Interlaboratorios: Organización, realización y
evaluación de mediciones o ensayos sobre el mismo ítem o ítems similares por
dos o más laboratorios u organismos de inspección, de acuerdo con condiciones
predeterminadas.
4.2 OEC: Organismo de evaluación de la
Conformidad. Para el caso de este documento, se refiere a los laboratorios de
ensayo y calibración, laboratorios clínicos y organismos de inspección (estos
últimos cuando aplique o sea relevante)
4.3 Ensayos
de aptitud: Evaluación
del desempeño de los participantes con respecto a criterios previamente
establecidos mediante comparaciones interlaboratorios.
4.
DEFINICIONES
Nota: Incluye, pero no se limita a:
a)
Programa cuantitativo – en el que el objetivo es cuantificar uno o más mensurandos del ítem de ensayos de aptitud.
b)
Programa cualitativo – en el que el objetivo es identificar o describir una o
más características del ítem de ensayos de aptitud.
c)
Programa secuencial – en el que se distribuyen uno o más ítems de ensayo de
aptitud secuencialmente para ensayo o medida y se devuelven a intervalos al
proveedor de ensayos de aptitud.
d)
Programa simultáneo – en el que se distribuyen ítems de ensayos de aptitud para
los ensayos y las mediciones simultáneas en un periodo de tiempo definido.
e)
Ejercicio aislado – en el que los ítems de ensayos de aptitud se proporcionan
por única vez.
f)
Programa continuo – en el que los ítems de ensayo de aptitud se proveen a
intervalos regulares
g)
Muestreo – en el que se toman muestras para su posterior análisis.
h)
Transformación e interpretación de datos – en los que se suministran conjuntos
de datos u otra información y se procesa la información para proporcionar una
interpretación (u otro resultado)
i)
Grupos pares- es un ensayo de aptitud, a un grupo que presumiblemente utiliza
métodos de ensayos idénticos 4.4 Familia de ensayos o calibraciones: Conjunto
de ensayos o calibraciones, en el que cualquiera de sus miembros es
razonablemente representativo de los demás en cuanto a la evaluación de la
calidad de los resultados obtenidos. Es decir, que el resultado en una intercomparación debe poder ser directamente correlacionado
con los otros grupos de propiedad/ productos incluidos en la misma familia. El
concepto de familia de ensayos o calibraciones no aplica a los laboratorios
clínicos.
4.5
Área de Laboratorio Clínico: Especialidad de la Microbiología Química Clínica que agrupa
los diferentes ensayos o análisis realizados en un laboratorio clínico. El
concepto de Área de Laboratorio Clínico solamente aplica a los laboratorios
clínicos.
4.6
Ítem de ensayos de aptitud: muestra, producto, artefacto, material de referencia, parte
de un equipo, patrón de medida, conjunto de datos u otra información utilizada
para los ensayos de aptitud
4.7
Laboratorios: en el
contexto de este documento implica todo tipo de laboratorio de ensayo,
calibración y clínicos.
4.8
Programa de ensayos de aptitud: ensayos de aptitud diseñados y operados en una o más rondas
para un área específica de ensayo, medida, calibración o inspección.
4.9
Proveedor de ensayos de aptitud: organización que es responsable de todas las tareas
relacionadas con el desarrollo y la operación de un programa de ensayos de
aptitud.
4.10
Requerimiento de Calidad: aplica
para laboratorios clínicos y se refiere al Error máximo tolerable (TEA) que es
la especificación acerca de la tasa de error que puede ser permitida en un
método analítico sin invalidar la utilidad clínica del resultado.
4.11
Ronda de ensayo de aptitud: secuencia completa única de distribución de ítems de ensayos
de aptitud, y evaluación y comunicación de los resultados a los participantes.
4.12
Valor asignado: valor
atribuido a una propiedad particular de un ítem de ensayo de aptitud.
Nota: un programa de ensayos de aptitud
puede cubrir un tipo particular de ensayo, calibración, inspección o varios
ensayos, calibraciones o inspecciones de ítems de ensayos de aptitud. 4.13
Valor atípico: observación en un conjunto de datos que parece no concordar
con los restantes datos de dicho conjunto.
5.1
Recolecta y difunde información, sobre programas de ensayos/pruebas de aptitud,
entre los laboratorios u organismos de inspección, cuando sea relevante en el
caso de organismos de inspección, acreditados y en proceso, para que
seleccionen y definan su participación en programas de este tipo; promociona en
particular, la participación en programas de ensayos de aptitud ofrecidas por:
proveedores de ensayos nacionales, que cuando sea posible cumplan con los
requisitos de la norma INTE-ISO/IEC 17043, en su versión vigente, IAAC y otros
organismos de cooperación especializados.
5.2
Utiliza los programas de ensayos/pruebas de aptitud como uno de los criterios
para evaluar la competencia técnica de los laboratorios y organismos de
inspección, cuando sea relevante en el caso de organismos de inspección, que
solicitan su Acreditación, y de los ya acreditados. y donde sea aplicable para
los organismos de inspección acreditados o en proceso de Acreditación, en
relación con sus actividades de ensayo.
5.3
Verifica durante las evaluaciones, que los laboratorios, tengan una Política y
procedimientos sobre la participación en ensayos/pruebas de aptitud, que
incluya como mínimo los siguientes aspectos:
5.4
Verifica durante las evaluaciones, que los laboratorios y organismos de
inspección (cuando se relevante para el caso de Organismos de Inspección),
documenten una justificación en caso de que no sea posible la participación en
este tipo de programas.
5.5
Requiere y verifica de los laboratorios y organismos de inspección (cuando sea
relevante en el caso de organismos de inspección), acreditados y de los que se
encuentran en proceso de Acreditación, que su participación sea efectiva y que,
cuando sea necesario, se tomen las acciones correctivas y que se apliquen
eficazmente.
Nota: Un valor atípico puede originarse a
partir de una población diferente o ser el resultado de un registro incorrecto o
de otro error de gran magnitud.
5.
CRITERIOS GENERALES
El Ente
Costarricense de Acreditación:
a)
La forma cómo el desempeño en estos programas se utiliza para demostrar su
competencia.
b)
La frecuencia de participación en intercomparaciones.
c)
Realización de análisis de causa y acciones correctivas en caso de resultados
no satisfactorios.
d)
La manera de medir la eficacia de las acciones correctivas tomadas en caso de
resultados no satisfactorios.
5.6
Mantiene información actualizada de la participación efectiva de los
laboratorios y organismos de inspección (cuando sea relevante en el caso de
organismos de inspección), acreditados o en proceso de acreditación, y de los
ensayos/pruebas de aptitud y otras comparaciones en los que han participado, para
lo cual:
6.1
En el caso de proveedores de ensayos de aptitud, la aplicación de todo lo
establecido en la presente política se realiza de acuerdo a lo indicado en el
documento ECA-MC-C15, de criterios para acreditación de proveedores de ensayos
de aptitud.
6.2
Demostración de la competencia técnica de los laboratorios y organismos de
inspección (cuando sea relevante en el caso de organismos de inspección) para
la realización de los ensayos, calibraciones e inspecciones acreditados o en
proceso, por medio de la participación en programas de ensayos/pruebas de
aptitud y otras comparaciones, donde tales actividades estuviesen disponibles.
6.3
Se reconoce que la competencia técnica puede ser también demostrada por la
participación en comparaciones interlaboratorios que
hayan sido organizadas para propósitos diferentes que para un ensayo de aptitud
en su estricto sentido, por ejemplo, para: 6.3.1 En cualquiera de los puntos
anteriores deben estar documentados los siguientes aspectos:
a)
Los laboratorios y organismos de inspección (cuando sea relevante en el caso de
organismos de inspección), deben remitir como mínimo una vez al año a ECA, el
formulario ECA-MC-P17-F01: Reporte de resultados de participación en
ensayos/pruebas de aptitud y otras comparaciones para los laboratorios, con la
información actualizada de su participación en ensayos de aptitud y otras
comparaciones.
b)
La información recibida por parte del OEC debe ser revisada y puesta a disposición
a los equipos evaluadores para que sea evaluada y verificada durante los
procesos de evaluación.
6
REQUISITOS ESPECIFICOS
El ECA, para
la Acreditación de laboratorios, proveedores de ensayos de aptitud y organismos
de inspección (cuando aplique), establece los siguientes requisitos en relación
con la participación en ensayos/pruebas de aptitud y otras comparaciones:
− Evaluar las características de desempeño de un método
− Caracterizar un material de referencia
− Comparar resultados de uno o más laboratorios
acreditados por su propia iniciativa
− Para respaldar las capacidades de medición y
calibración de Laboratorios Nacionales o Designados por LACOMET.
a) Evidencia de que todos los participantes conocen sobre el
ejercicio de comparación que se está ejecutando, y que se encuentran de acuerdo
en participar en el mismo
b) Fecha de entrega del ítem de ensayo o calibración.
c) Modo de
entrega del ítem de ensayo o calibración.
d) Tipo y número de ítem a ensayar o
calibrar.
e) El método de ensayo o calibración a ser
usado.
f) Los parámetros a determinar.
g) Forma de evaluar la estabilidad y
homogeneidad, cuando aplique, de muestras o equipos
h) Técnica estadística utilizada para
determinar el valor asignado a la o las propiedades a medir en la comparación.
La técnica empleada debe cumplir lo indicado en la norma INTE-ISO/IEC 17043, en
su versión vigente.
i) Los criterios de aceptabilidad y
evaluación. La estadística empleada para evaluar el desempeño del ejercicio interlaboratorio debe cumplir lo indicado en la norma
INTE-ISO/IEC 17043, en su versión vigente. 6.3.2 El ítem de calibración
utilizado debe cumplir con lo establecido en ECA-MC-P20: Política de
Trazabilidad o el ítem de ensayo debe ser un material de referencia certificado
y cumplir con lo establecido en ECA-MC-P20: Política de Trazabilidad. Si no se
utiliza un material de referencia certificado, el ítem de ensayo debe cumplir
con los siguientes requerimientos:
i.
Debe ser producido y/o caracterizado por: − Laboratorios acreditados por
el ECA, cuyo alcance incorpore el respectivo método de ensayo o calibración.
−
Laboratorio Costarricense de Metrología, LACOMET.
−
Laboratorios Reconocidos o designados por LACOMET.
−
Laboratorios con alcances acreditados por un organismo de Acreditación homólogo
que firme Acuerdo de Reconocimiento Mutuo (MRA) o firmantes de un Acuerdo
Multilateral (MLA) en un Foro Internacional (IAAC, ILAC, APLAC, EA).
−
Los proveedores de ensayos de aptitud que cumplan con los criterios del punto
10 de este documento.
ii.
El valor asignado debe incluir la incertidumbre asociada a cada parámetro de
interés a ser analizado, siempre que sea posible su determinación.
6.4
Los laboratorios y organismos de inspección (cuando sea relevante en el caso de
organismos de inspección), deben seguir la frecuencia y requisitos para las
familias, establecidos en el anexo 1 de este documento.
Nota 1: La fecha de referencia para la
frecuencia de participación descrita en el punto 6.4, es la fecha en la que el proveedor
del ensayo de aptitud o intercomparación, emite el
informe final con los resultados obtenidos por el OEC en el ensayo de aptitud o
intercomparación.
Nota 2: En caso de que haya requerimientos
legales sobre la participación en intercomparaciones,
estos deben ser tomados en cuenta. 6.5 Para laboratorios y organismos de
inspección (cuando sea relevante en el caso de organismos de inspección) que
tengan más de una sede crítica, tanto fija como temporal o de proyecto, se debe
aplicar lo siguiente según corresponda: 6.5.1 Si las diferentes sedes críticas
realizan actividades, ensayos o calibraciones, clasificadas dentro de distintas
familias, o áreas de laboratorios clínicos, ver anexo 1, para cada sede, deben
participar en ensayos de aptitud, siguiendo todo lo establecido en la presente
política, como si cada sede fuese un laboratorio u organismo independiente.
6.5.2
Si las diferentes sedes críticas realizan actividades, ensayos o calibraciones,
que se encuentran clasificadas dentro de las mismas familias, o áreas de
laboratorios clínicos, ver anexo 1, se debe aplicar uno de los siguientes
requisitos sobre participación en comparaciones: 6.5.2.1 Cada sede puede
participar en ensayos de aptitud, siguiendo todo lo establecido en esta
política, como si fuese un laboratorio u organismo independiente.
6.5.2.2
El laboratorio u organismo de inspección (cuando sea relevante en el caso de
organismos de inspección) selecciona la sede que participa en ensayos de
aptitud, siempre cumpliendo siempre todo lo establecido en este documento, y
adicionalmente debe ejecutar, aplicando métodos estadísticos válidos, y
adecuados, y documentados, procesos de comparación internos entre la sede que
participa en ensayos de aptitud y las demás sedes que no participan en los mismos,
esto con la finalidad de garantizar, estadísticamente, que no existen
diferencias significativas en la ejecución de ensayos o calibraciones entre las
sede que participa en ensayos de aptitud y las sedes que no participan en los
mismos. 6.5.2.2.1 Cuando un OEC, que aplique lo indicado en 6.4.2.2, obtenga un
resultado cuestionable o no satisfactorio en sus participaciones en ensayos de
aptitud, debe contemplar a todas sus sedes críticas acreditadas al aplicar lo
descrito en los apartados 6.10, 6.11 y 6.12.
6.5.3
Tanto para el informe de resultados de participación en ensayos de aptitud que
se envía al ECA, según el apartado 5.6, como en la elaboración y envío del plan
de intercomparaciones, según apartado 7, el OEC debe
incluir todo lo relacionado con la información de ensayos de aptitud o
comparaciones internas para sus sedes críticas.
6.5.4
En caso de no existir programas de ensayos de aptitud en alguna o varias
familias de ensayos o calibraciones, o áreas de laboratorios clínicos, el OEC
debe aplicar lo indicado en el apartado 6.10 de este documento, tomando en
cuenta sus sedes críticas, esto en caso de que ninguna pueda participar, por no
existencia de programas de intercomparaciones, en
ensayos de aptitud.
6.6
Se requiere evidencia de participaciones satisfactorias, conforme a las
familias de ensayos, calibraciones o microorganismos a ensayar, o áreas de
laboratorios clínicos, definidas en el anexo 1, antes de una acreditación
inicial o de una ampliación de la acreditación, en la forma que se describe a
continuación:
6.6.1
Cuando se trate de una acreditación inicial o ampliación de alcance, el
laboratorio u organismo de inspección (cuando sea relevante en el caso de
organismos de inspección), debe obtener resultados satisfactorios en ensayos de
aptitud, para al menos un cuarto de las familias de actividades, ensayos,
calibraciones o microorganismos a ensayar definidas en el anexo 1, en el caso
de los laboratorios clínicos, al menos un cuarto de los ensayos de cada área, y
que estén incorporadas en el alcance de acreditación o ampliación solicitada,
cuando estén disponibles, (ver requisito 6.10).
6.6.2
La participación no debe exceder los doce meses anteriores a la presentación de
la solicitud. La participación satisfactoria no es requisito para la admisibilidad
de la solicitud, pero si es requisito indispensable para el otorgamiento de la
acreditación o ampliación.
6.6.3
En ningún caso se otorga la acreditación si el laboratorio u organismo de
inspección (cuando sea relevante en el caso de organismos de inspección), no
demuestra que haya participado en ensayos de aptitud con resultados
satisfactorios, según la tabla del anexo 1, cuando hay disponibles.
6.7
Cuando exista más de un funcionario autorizado para ejecutar actividades dentro
del alcance de acreditación, debe alternarse el personal involucrado durante la
participación en intercomparaciones, de forma tal,
que pueda ser evaluada la mayor cantidad del personal de manera externa.
6.8
En caso de que haya cambios significativos en los procedimientos o en el
personal involucrado en las actividades acreditadas, de acuerdo con el
ECA-MP-P09-F02, Compromiso de Acreditación, se exige la participación en la
próxima prueba de aptitud disponible o sino la aplicación de lo establecido en
el requisito 6.10.
6.9
Para el caso de organismos de inspección, deben participar cuando sea relevante
y estén disponibles los ensayos de aptitud. (Ver apartado 3 respecto al término
"relevante")
6.10
En el caso de no existir disponibles programas de ensayos/pruebas de aptitud,
el laboratorio u organismo de inspección (cuando sea relevante en el caso de
organismos de inspección), acreditado o en proceso de acreditación o
ampliación, debe: 6.10.1 Documentar una justificación en caso de que no sea
posible la participación en este tipo de programas.
6.10.2
Demostrar por algún otro medio, debidamente documentado, que posee la
competencia técnica, para las actividades acreditadas los ensayos/
calibraciones acreditados o en proceso de Acreditación, por cualquiera de los
siguientes métodos:
a)
El uso regular de materiales de referencia certificados o un control de calidad
interno utilizando materiales de referencia secundarios.
b)
La repetición de ensayos o calibraciones utilizando el mismo método o métodos
diferentes.
c)
La repetición del ensayo o de la calibración de los objetos retenidos.
d)
La correlación de los resultados para diferentes características de un ítem.
e)
Para laboratorios clínicos pueden aplicarse los siguientes aspectos:
i.
Los materiales de referencia certificados
ii.
Las muestras previamente analizadas.
iii.
Intercambio de muestras con otros laboratorios.
iv.
El control de los materiales que se ponen a prueba diariamente como parte del
control intralaboratorio. 6.11 El laboratorio u organismo
de inspección (cuando sea relevante en el caso de organismos de inspección),
acreditado o en proceso de acreditación, o ampliación, debe realizar un
análisis crítico de los resultados provenientes de su participación en
programas de ensayos de aptitud y las investigaciones de cualquier resultado no
satisfactorio y cuestionable, la aplicación del control de ensayos/
calibraciones no conformes y las acciones correctivas consiguientes, así como
la definición del plazo de corrección comprometido. 6.11.1 En el caso de los
laboratorios clínicos: cuando el laboratorio tenga participaciones no
satisfactorias, debe demostrar el cumplimiento con su requerimiento de calidad,
en caso que el resultado se encuentre fuera del requerimiento, se requiere el
análisis de causas, el planteamiento de acciones correctivas necesarias y la
verificación de efectividad de sus acciones correctivas aplicadas en los
siguientes interlaboratoriales. El requerimiento de
calidad debe proveer, tanto como sea posible desafíos clínicamente pertinentes.
6.12
La información del análisis anterior (investigaciones de resultados no
satisfactorios y cuestionables, la aplicación del control de ensayos/
calibraciones no conformes y las acciones correctivas y los plazos para su
implementación) deben ser entregados a la Secretaría de Acreditación respectiva
en un plazo de 30 días hábiles a partir de la fecha en que se recibieron los
resultados por parte del proveedor, para el caso de laboratorios clínicos, la
información se debe presentar en un plazo de 15 días hábiles.
6.13
Solo en el caso de obtener resultados insatisfactorios, el laboratorio u
organismo de inspección (cuando sea relevante en el caso de organismos de
inspección), acreditado o en proceso de acreditación o ampliación, debe participar
en ensayos/pruebas de aptitud u otras comparaciones subsecuentes, que estén
disponibles, o cumplir con el punto 6.10 de este documento, en un plazo no
mayor de seis meses de recibido el resultado insatisfactorio, para demostrar
que las acciones correctivas fueron efectivas.
El uso de los
datos provenientes de estas fuentes, deben seguir los mismos principios
relativos al seguimiento de desempeños no satisfactorios, ver apartados 6.11 y
6.12.
La Secretaría
de Acreditación es responsable de dar seguimiento a la implementación de las
acciones correctivas y de apoyarse en el equipo evaluador si fuera necesario.
Nota 1: El envío de esta información puede
coincidir o no con el reporte del requisito 6.13.
Nota 2: El análisis debe ser remitido tanto
por los laboratorios u organismos de inspección (cuando sea relevante en el
caso de organismos de inspección) acreditados como en proceso de acreditación o
ampliación. 6.14 El laboratorio u organismo de inspección (cuando sea relevante
en el caso de organismos de inspección), acreditado o en proceso de
acreditación o ampliación, debe mantener registros actualizados conteniendo los
programas de ensayos de aptitud en que participó, con la siguiente información,
cuando sean aplicables:
6.15 El laboratorio u organismo de inspección
(cuando sea relevante en el caso de organismos de inspección), ya sea
acreditado o en proceso de acreditación o ampliación, debe entregar al ECA, el
documento ECA-MC-P17-F01: Reporte de resultados de participación en
ensayos/pruebas de aptitud y otras comparaciones. Este reporte debe entregarse,
de manera anual, dos meses antes de las evaluaciones de seguimiento o
reevaluaciones y en el caso de evaluaciones iniciales o de ampliación, el
reporte se debe entregar en los anexos remitidos con la respectiva solicitud.
El ECA-MC-P17-F01, debe incorporar todos los resultados satisfactorios,
cuestionables y no satisfactorios obtenidos por el laboratorio u organismo de
inspección (cuando sea relevante en el caso de organismos de inspección), así como
las actividades realizadas para los casos donde no hay disponibles programas de
aptitud u otras comparaciones, ver apartado 6.10.
6.16 La información anterior debe ser
entregada por la Secretaría de Acreditación respectiva al equipo evaluador para
ser analizada y evaluada durante las evaluaciones iniciales, ampliaciones,
seguimiento o reevaluación.
6.17 Los laboratorios, proveedores de ensayos
de aptitud y organismos de inspección (cuando sea relevante en el caso de
organismos de inspección), deben hacerse cargo de los costos de su
participación en programas de ensayos de aptitud conforme a lo definido en las
reglas y/ o condiciones de cada programa.
La
demostración de que las acciones correctivas fueron efectivas es un requisito
indispensable para el otorgamiento de la ampliación o acreditación inicial.
a)
Fecha de realización
b)
Organizador, nombre y frecuencia de realización del programa
c)
Tipo de ensayo / calibración, magnitudes o características medidas, ensayadas o
calibradas, método de ensayo/calibración empleado por el laboratorio.
d)
Materiales / Patrones de referencia certificados utilizados para corroborar la
exactitud y precisión obtenidas en los ensayos.
e)
Matrices ensayadas / Equipos calibrados
f)
Personal que participó.
g)
Criterio de aceptación de los resultados o evaluación del desempeño.
h)
Resultados obtenidos con sus incertidumbres asociadas.
i)
Acciones correctivas pertinentes (en el caso de haber obtenido resultados no
satisfactorios).
7.1
El laboratorio u organismo de inspección (cuando sea relevante en el caso de
organismos de inspección), debe formular un plan de participación en intercomparaciones que comprenda, en un periodo de 4 años,
la participación del OEC en comparaciones para todas sus familias de
actividades acreditadas, o áreas, que refleje el cumplimiento del anexo 1. El
plan debe ser presentado al ECA para su respectiva revisión, y posterior
aprobación por parte de la secretaría de acreditación respectiva. Si se
requiere de algún apoyo técnico en la revisión del plan se puede solicitar la
colaboración del comité asesor respectivo, o asesoría a expertos externos si se
considera necesario.
7.2
El ECA tiene un mes para responder si acepta el plan o si requiere cambios.
7.3
El plan debe entregarse cada 4 años y actualizarse ante cualquier cambio en el
mismo.
7.4
La revisión del plan de participación en intercomparaciones,
se realiza con el fin de determinar si es adecuado para el alcance de
acreditación del laboratorio u organismo de inspección (cuando sea relevante en
el caso de organismos de inspección), y conforme a las frecuencias mínimas y
familias, o áreas, establecidas en el anexo 1.
7.5
El plan debe incluir como mínimo:
7.6
El laboratorio u organismo de inspección (cuando sea relevante en el caso de
organismos de inspección), debe utilizar el formato ECA-MC-P17-F03: Plan de intercomparaciones, para la presentación del plan al ECA.
7 PLAN DE
PARTICIPACIÓN EN INTERCOMPARACIONES
Nota 1: Se debe tener en cuenta que los
proveedores publican los cronogramas anualmente por lo que este plan puede
cambiar según las programaciones de los proveedores de rondas.
− Organizador del programa.
− Fecha o periodo de participación.
− Ensayos, calibraciones o inspecciones en los que
participará.
− Personal responsable de la ejecución.
−
Actividades alternativas a realizar, con su respectiva frecuencia establecida,
por parte del laboratorio u organismos de inspección para las actividades en
las cuáles no exista un programa de ensayos de aptitud y la justificación
técnica por la que no se puedan participar.
Nota 1: Para la realización del plan se
pueden consultar las siguientes direcciones de proveedores de rondas:
http://www.eptis.bam.de/en/index.htm
http://www.a2la.org/dirsearchnew/ptproviders.cfm
http://www.scc.ca/en/complete-listing-palcan-directory-of-accredited-clients
7.7 Una vez que el plan ha sido aprobado por parte de la Secretaría de
Acreditación respectiva, el cumplimiento del mismo, es revisado por el equipo
evaluador durante las evaluaciones de seguimiento y reevaluación.
7.8
El plan debe ser actualizado por el laboratorio u organismo de inspección
(cuando sea relevante en el caso de organismos de inspección), cuando:
7.9
Una vez otorgada la ampliación o acreditación inicial, el OEC cuenta con 20
días hábiles para la entrega del ECA ECA-MC-P17-F03, Plan de intercomparaciones al ECA.
http://www.ema.org.mx/ema/ema/index.php?option=com_content&task=blogcategory&id=130&Itemid=157
http://www.mollabs.com
http://www.sim-metrologia.org.br/
https://www.api-pt.com/
www.lgcstandards.com/
www.fapas.com/
www.aoac.org/proficiencytesting/proficiency.html
www.bipea.org
www.cap.org
Colegio Americano de Patólogos (CAP)
www.sysmex.com
Corporación Sysmex-Programa de comparación insight
www.riqas.net RIQAS External Quality Assessment
Program
www.stago-us.com/products.../stago.../proeficiency-testing-quality-assurance-servicies
Qualiris by Stago
www.bio-rad.com/ external-quality-assurance-services
(EQAS®)
www.ukneqas.org.uk-
UKNEQAS
www.nascola.org-
NASCOLA
www.lacomet.go.cr/ensayoaptitud
Nota 1: Algunos de los proveedores no dan
servicios en otros países.
Nota 2: La lista anterior no es exhaustiva y
se actualizará según sea requerido.
a)
Ocurran cambios en metodología o instrumentación, que tenga incidencia directa
en el resultado del ensayo, calibración o inspección.
b)
Cuando se otorgue una ampliación, cuyas familias o áreas no estén cubiertas por
el alcance ya acreditado, el OEC entrega un plan nuevo y específico para la
ampliación otorgada y debe cumplir los requisitos de este apartado
c)
Cuando se publiquen los cronogramas anuales y no coincidan con lo planeado.
8 MONITOREO
DEL DESEMPEÑO EN INTERCOMPARACIONES
8.1 Los
resultados de la participación en los programas de ensayos de aptitud serán
monitoreados en las evaluaciones del ECA para:
8.2 Durante las evaluaciones, el equipo
evaluador utiliza como criterio de aceptación el establecido por el organizador
del ensayo/ prueba de aptitud y otras comparaciones. La información sobre los
resultados de intercomparaciones debe ser documentado
por el equipo evaluador en el Informe final de evaluación respectivo, el cual
es analizado durante los procesos posteriores a la evaluación y el proceso de
toma de decisión, según corresponda.
8.3 El laboratorio u organismo de inspección
(cuando sea relevante en el caso de organismos de inspección), debe poder
aportar, en las evaluaciones, información sobre el diseño del programa,
incluyendo la frecuencia, procedimiento para establecer valores asignados,
instrucciones para los participantes, tratamiento estadístico de los datos y el
informe final de cada ensayo de aptitud seleccionado.
8.4 En caso de que el laboratorio u organismo
de inspección (cuando sea relevante, en el caso de organismos de inspección):
8.4.1 No cumpla con haber participado en el número de programas de ensayos de
aptitud requeridos.
8.4.2
No demuestre haber tomado medidas correctivas apropiadas o éstas no hayan
resultado ser efectivas;
8.4.3
Obtuviera desempeños insatisfactorios consecutivos, para la misma familia.
8.4.4
Para el caso de laboratorios clínicos, teniendo en cuenta que tienen una alta
frecuencia de participación en los programas de evaluación externa de la
calidad, se iniciarán procesos de investigación para analizar la situación y
tomar medidas si lo considerara necesario, si el laboratorio clínico obtuviere
para cada analito:
a.
6 encuestas no satisfactorias consecutivas con frecuencia igual o menor quincenal
de participación
b.
3 encuestas no satisfactorias consecutivas con frecuencia igual o menor mensual
de participación
c.
2 encuestas no satisfactorias consecutivas con frecuencia mayor mensual de
participación
a)
Asegurar el adecuado desempeño de los laboratorios u organismos de inspección
(cuando sea relevante en el caso de organismos de inspección)
b)
La eficacia de las acciones tomadas para los resultados cuestionables o no
satisfactorios.
c)
En los laboratorios clínicos, los cálculos realizados para demostrar que los
resultados cuestionables no se salen del requerimiento de calidad establecido
por el laboratorio.
Se
considerarán resultados No Satisfactorios para el Laboratorio Clínico cuando
así lo indique el proveedor de ensayos de aptitud y el valor informado por el
Laboratorio quede excluido de acuerdo al requerimiento de calidad definido por
el laboratorio.
9.1 El ECA
acepta los siguientes proveedores de ensayos/ pruebas de aptitud y otras
comparaciones: 9.1.1 Cualquier programa de ensayos de aptitud en el cual los
OEC deseen participar, que demuestren conformidad con la norma ISO/IEC 17043,
cuando sea aplicable, a través de evidencia de la acreditación del proveedor en
la norma ISO/IEC 17043, o por la evaluación por pate del laboratorio al
proveedor del ensayo de aptitud no acreditado. En el último caso, el
laboratorio debe hacer uso de su procedimiento de compras de servicios y
suministros para demostrar la conformidad del proveedor de ensayos de aptitud o
intercomparaciones, con los siguientes requisitos de
la norma ISO/IEC 17043: 9.1.1.1 Preparación apropiada de las muestras o ítem a
ensayar o calibrar.
9.1.1.2
Homogeneidad y estabilidad de la muestra o ítem de ensayo de aptitud.
9.1.1.3
Diseño estadístico.
9.1.1.4
Forma o mecanismo para establecer el valor asignado al ítem del ensayo de
aptitud.
9.1.1.5
Análisis de datos.
9.1.2
Los programas de aptitud realizados por:
i.
Cooperación Interamericana de Acreditación (IAAC).
ii. Asia Pacific Laboratory
Accreditation Cooperation (APLAC),
iii. European Cooperation
Accreditation (EA)
iv. Southern African Development
Community Cooperation in Accreditation (SADCA),
v.
Laboratorio Costarricense de Metrología (LACOMET) o los laboratorios nacionales
designados por LACOMET.
vi.
Comparaciones clave o suplementarios del Sistema Interamericano de Metrología
(SIM)
vii.
Colegio Americano de Patólogos (CAP)
viii.
Corporación Sysmex-Programa de comparación insight
El ECA procede
conforme a lo establecido en ECA-MC-P16: Procedimiento de investigación.
9 CRITERIOS
ESPECÍFICOS PARA LA EVALUACIÓN DE PROVEEDORES DE ENSAYOS/ PRUEBAS DE APTITUD Y
OTRAS COMPARACIONES PARA LOS LABORATORIOS Y ORGANISMOS DE INSPECCIÓN (cuando
sea relevante para el caso de organismos de inspección)
ix.
Los ensayos de aptitud organizados por proveedores de ensayos de aptitud
reconocidos por organismos de acreditación signatarios del MLA de IAAC y del
MRA de APLAC y de ILAC.
10
BIBLIOGRAFIA
− Norma INTE-ISO/IEC 17011. Evaluación de la
conformidad- Requisitos Generales para los organismos de Acreditación que
realizan la acreditación de organismos de evaluación de la Conformidad.
− Norma INTE-ISO/IEC 17025. Requisitos Generales para
la competencia de los laboratorios de ensayo y calibración.
− Norma INTE-ISO 15189 Laboratorios de análisis
clínicos. Requisitos Particulares para la calidad y la competencia.
− Norma INTE-ISO/IEC 17043 Evaluación de la conformidad
— Requisitos generales para los ensayos de aptitud.
−
ILAC-P9: 06/2014, ILAC Policy for Participation in Proficiency Testing
Activities.
11.1 Anexo 1: Requisitos de participación 11.1.1 ECA podrá modificar las
frecuencias y familias con base en la importancia de los ensayos, inspecciones
cuando aplique, o calibraciones, o por solicitudes de autoridades reguladoras.
La lista presentada no pretende ser exhaustiva y se actualizará cuando se
considere necesario por parte de los Comités Asesores respectivos.
11.1.2 Cuando un ensayo o calibración no se encuentre dentro
de alguna familia, el Comité Asesor respectivo analiza el caso y toma la
decisión al respecto, para lo cual cuenta con un tiempo de 10 días hábiles, una
vez presentado el caso.
11.1.3
Requisitos de Área y Frecuencia de participación para Laboratorios que realizan
análisis clínicos acreditados con INTE-ISO/IEC 17025 o INTE-ISO 15189:
|
11 ANEXO Área |
Frecuencia por cada ensayo
dentro del alcance |
|
Bacteriología, micología,
virología y Parasitología |
1 anual |
|
Química Clínica |
3 anuales |
|
Hormonas |
1 anual |
11.1.4 Requisitos
de familias y frecuencia de participación para Laboratorios que realizan
análisis microbiológicos:
|
Toxicología
Clínica (incluye metales pesados) |
1 anual
|
|
Marcadores
tumorales |
3
anuales |
|
Uroanálisis (análisis general de orina) |
1 anual
|
|
Hematología
Coagulación
|
3
anuales |
|
Inmunología
o Serología |
1 anual
|
|
Biología
Molecular (Incluye pruebas de paternidad) |
1
bianual |
|
Citogenética
Genética
Clínica, Genética
Humana |
1
bianual |
|
Inmunohematología y Banco de Sangre (pruebas de
compatibilidad, pruebas de Coombs , rastreo de anticuerpos, grupo ABO/RH) |
1 anual
|
|
Banco
de Tejidos y Terapia Celular |
1
bianual |
11.1.4
Requisitos de familias y frecuencia de participación para Laboratorios que realizan
análisis microbiológicos:
|
Matriz |
Microorganismos
a ensayar |
Requisitos
de Participación |
||||
|
Agua
Residual, Agua de Mar, Aguas |
Salmonella
spp |
•
• 1 participación cada 4 años por cada microorganismo
a ensayar para cada matriz enlistada. •
• Cuando se tengan más de un método
acreditado para un mismo microorganismo dentro de una misma matriz deben
alternarse la participación en intercomparaciones,
para los diferentes métodos, cada 4 años. |
||||
|
Escherichia coli
|
||||||
|
Recuento
total aerobio mesófilos |
||||||
|
Coliformes totales, fecales |
||||||
|
Staphylococcus aureus
|
||||||
|
Enterococos fecales |
||||||
|
Listeria
spp |
||||||
|
Agua |
Salmonella
spp |
|||||
|
Escherichia coli
|
||||||
|
Recuento
total aerobio mesófilos |
||||||
|
Coliformes totales, fecales |
||||||
|
Enterococcos fecales |
||||||
|
Staphylococcus aureus
|
||||||
|
Listeria
spp |
||||||
|
Pseudomonas aeruginosa
|
||||||
|
Legionella pneumophila
|
||||||
|
Alimentos
(incluye alimentos, bebidas y bebidas alcohólicas) |
Salmonella
spp |
|||||
|
Escherichia coli
|
||||||
|
Recuento
total aerobio |
||||||
|
•
11.1.5 Familias y frecuencia de
participación para Laboratorios que realizan ensayos físicos de materiales de
construcción: •
|
||||||
|
Productos
|
Familia
de ensayos |
Requisitos
de participación |
|
|||
|
Concretos
|
Incluye
ensayos en concretos, mampostería y prefabricados. |
•
• 1 participación cada 4 años, por cada
familia de ensayos enlistada. •
• Cuando se tenga más de un ensayo o método
acreditado dentro de la familia, deben alternarse las intercomparaciones
cada 4 años. |
|
|||
|
Cementos
|
Incluye
ensayos en cemento |
|
||||
|
Agregados
|
Incluye
ensayos en Agregados |
|
||||
|
Varillas
y aceros |
Incluye
ensayos en varillas y acero |
|
||||
|
Suelos |
Incluye
ensayos de Suelos |
|
||||
|
Asfaltos
|
Incluye
ensayos en Mezclas Asfálticas y ligantes
asfálticos. |
|
||||
•
11.1.6 Familias y frecuencia de participación
para Laboratorios que realizan calibraciones:
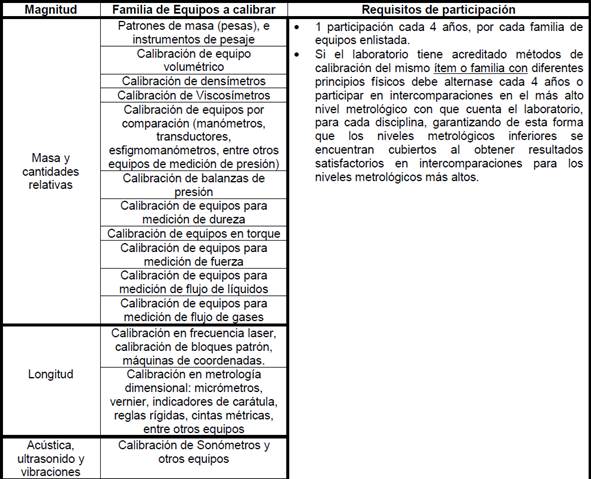
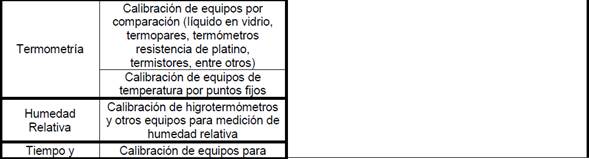
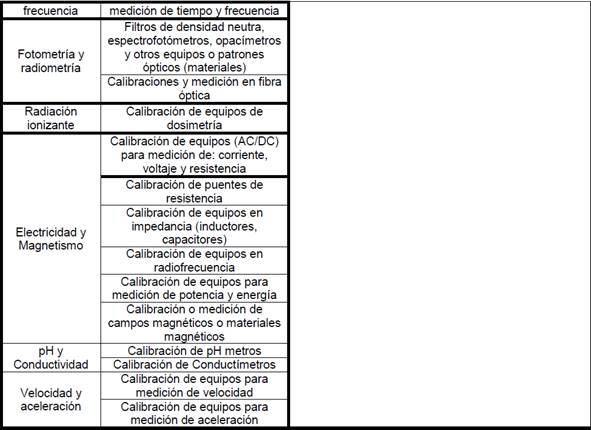
•
11.1.7
Familias y frecuencia de participación para Laboratorios que realizan análisis
fisicoquímico de agua potable, residual, de mar o recreacionales:
•
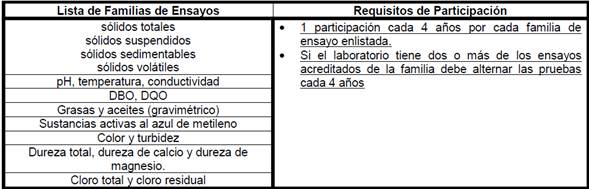
•
11.1.8
Familias y frecuencias de participación para Laboratorios que realizan análisis
químicos instrumentales y otros ensayos fisicoquímicos:
•
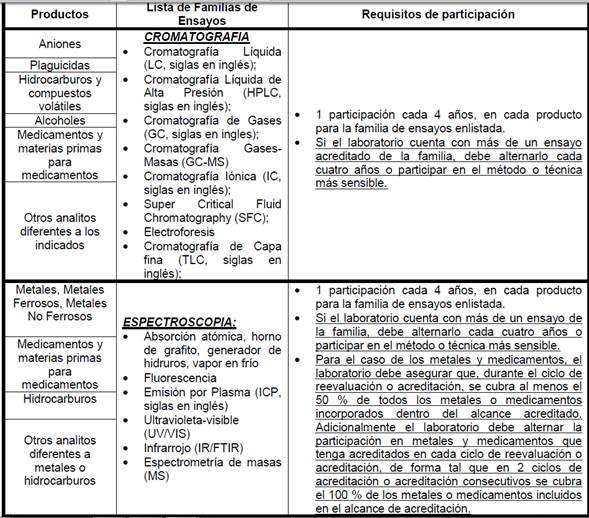

•
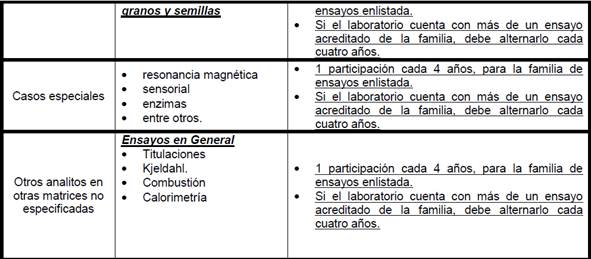
11.1.9
Familias y Frecuencia de participación para Laboratorios que realizan ensayos
en el área eléctrica-electrónica, eficiencia energética:
•
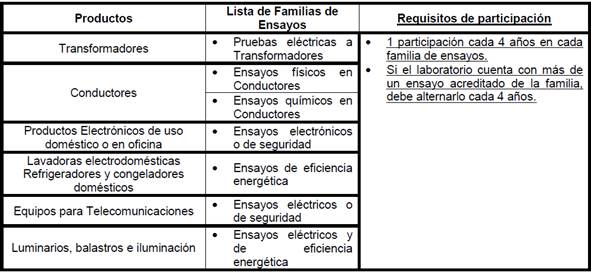
•
11.1.10
Familias y frecuencia de participación para Laboratorios que realizan ensayos
en ambientes laborales:
•

•
11.1.11
Familias y frecuencia de participación para Laboratorios que realizan ensayos en
aire o fuentes de emisión:
•

•
11.1.12
Familias y frecuencia de participación para Laboratorios que realizan ensayos
en metal mecánica, mecánicos y físicos para diversos materiales:
•
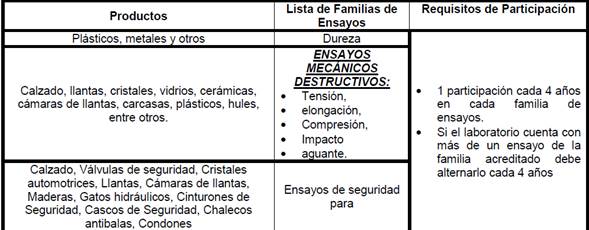
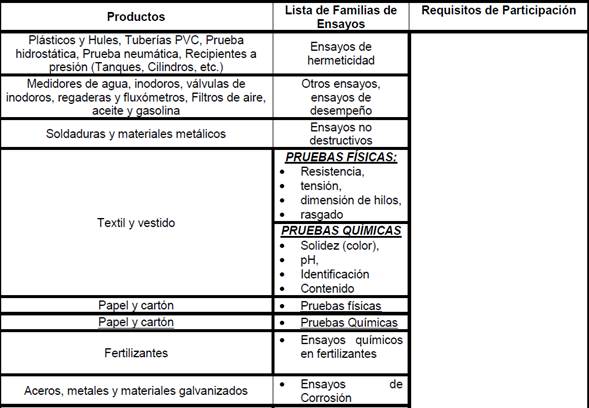
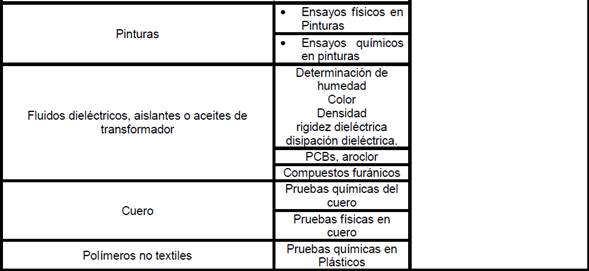
•
11.1.13
Familias y frecuencia de participación para Laboratorios que realizan ensayos
de destilados de petróleo:
•

•
11.1.14
Familias y frecuencia de participación para laboratorios que realizan ensayos
en Otras áreas de análisis:
•
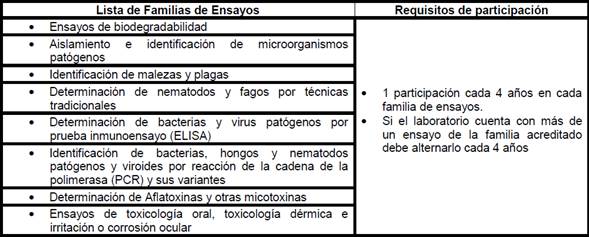
|
12
IDENTIFICACIÓN DE CAMBIOS Motivo: |
Modificación
del procedimiento ECA-MC-P17 |
|
Refiérase
a la solicitud de elaboración o modificación del documento número 2018-031 |
|
|
Observaciones:
Se
subrayan las modificaciones en el documento aprobado. |
|