- ENTE COSTARRICENSE DE
ACREDITACIÓN
Modificación de documentos 001-2012
El Ente
Costarricense de Acreditación (ECA), da a conocer la modificación de los
documento códigos ECA-MC-P09 Procedimiento general de evaluación y
acreditación, ECA-MC-P11 Procedimiento general de evaluación, acreditación y de
testificación para Organismos de Certificación, ECA-MC-P14 Otorgamiento de la
acreditación, ECA-MC-P16 Procedimiento de Investigación, ECA-MC-P17 Política y
criterios para la participación en ensayos/pruebas de aptitud y otras
comparaciones para los laboratorios, ECA-MC-P21 Reclutamiento, selección,
incorporación, evaluación del desempeño y cambios de categoría al cuerpo de
evaluadores y expertos técnicos, ECA-MC-P23 Conformación y sesión de los
órganos colegiados, ECA-MC-PO01 Política de validación de métodos, ECA-MC-PO02
Política de incertidumbre de las mediciones, ECA-MC-MA-P01 Pago a evaluadores y
expertos técnicos, ECA-MC-MA-P03 Procedimiento de cobro emitidos el 13 de
diciembre del 2012, de la siguiente manera:
- (Nota de
Sinalevi: La presente norma se extrajo del sitio web de Ente Costarricense de
Acreditación, y se transcribe a continuación:)

TABLA DE CONTENIDO
1. OBJETIVO ..................................................................................................................................
1
2. ALCANCE
..................................................................................................................................
1
3. INTRODUCCIÓN
..........................................................................................................................
1
4. DOCUMENTOS DE REFENCIA
..................................................................................................
2
5.
DEFINICIONES...........................................................................................................................
2
6. CRITERIOS PARA LABORATORIOS DE CALIBRACIÓN
............................................................ 4
7. CRITERIOS PARA LABORATORIOS DE ENSAYO.
.................................................................... 7
8.
TRANSITORIO............................................................................................................................
8
9. BIBLIOGRAFÍA
............................................................................................................................
9
10. ANEXOS: EJEMPLOS DE ESTIMACIÓN DE INCERTIDUMBRE:
........................................... 10
11. CONTROL DE CAMBIOS
........................................................................................................
22
1. OBJETIVO
Establecer los lineamientos que deben cumplir los
laboratorios de ensayo, laboratorios clínicos y laboratorios de calibración,
con respecto a la expresión de la incertidumbre de las mediciones.
2. ALCANCE
Esta política de expresión de la incertidumbre de las
mediciones, aplica a todos los laboratorios de calibración acreditados o en
proceso de evaluación y acreditación y a los laboratorios de ensayo y clínicos,
acreditados y en proceso de acreditación, en los casos que sea posible realizar
una estimación de incertidumbre.
3. INTRODUCCIÓN
El conocimiento y la expresión de la incertidumbre de
mediciones constituyen una parte indisoluble de los resultados de las
mediciones.
Es un elemento indispensable de la trazabilidad de las
mediciones. Es requerida también en la verificación de conformidad con
especificaciones demostrables mediante resultados de mediciones.
La evaluación de incertidumbres no es una tarea de rutina ni
puramente matemática; depende del conocimiento detallado de la naturaleza de
los mensurandos y de las mediciones.
En el presente documento, se utilizará el término abreviado
incertidumbre en lugar de incertidumbre de medición.
La expresión del resultado de una medición está completa sólo
cuando contiene tanto el valor atribuido al mensurando como la incertidumbre de
medición asociada a dicho valor.
Como parte de los requisitos que debe cumplir el ECA como
miembro firmante del reconocimiento Multilateral con ILAC e IAAC, se describe a
continuación la política de incertidumbre que deben cumplir los laboratorios de
ensayo, clínicos y calibración indicados en el alcance del presente documento,
en cumplimiento de lo establecido en el procedimiento ILAC P14-2010.
4. DOCUMENTOS DE REFENCIA
No aplica.
5. DEFINICIONES
5.1 Concepto de incertidumbre de las mediciones
Parámetro no negativo que caracteriza la dispersión de los
valores atribuidos a un mensurando, a partir de la información que se utiliza
NOTA 1 — La incertidumbre de medida incluye componentes
procedentes de efectos sistemáticos, tales como componentes asociadas a
correcciones y a valores asignados a patrones, así como la incertidumbre debida
a la definición. Algunas veces no se corrigen los efectos sistemáticos
estimados y en su lugar se tratan como componentes de incertidumbre.
NOTA 2 — El parámetro puede ser, por ejemplo, una desviación
típica, en cuyo caso se denomina incertidumbre típica de medida (o un múltiplo
de ella), o una semi-amplitud con una probabilidad de cobertura determinada.
“3.3.1 La incertidumbre del resultado de una medición
refleja la falta de conocimiento exacto del valor del mensurando. El resultado
de una medición después de la corrección por efectos sistemáticos reconocidos
es aún sólo una estimación del valor del mensurando debido a la presencia de
incertidumbre por efectos aleatorios y de correcciones imperfectas de los
resultados por efectos sistemáticos.
3.3.2 En la práctica, existen muchas fuentes posibles de
incertidumbre en una medición, incluyendo:
a.
Definición incompleta del mensurando;
b.
Realización imperfecta de la definición del mensurando.
c.
Muestreos no representativos –la muestra medida puede no representar el
mensurando definido;
d.
Conocimientos inadecuados de los efectos de las condiciones ambientales sobre
las mediciones, o mediciones imperfectas de dichas condiciones ambientales;
e.
Errores de apreciación del operador en la lectura de instrumentos analógicos;
f.
Resolución finita del instrumento o umbral de discriminación finito;
g.
Valores inexactos de patrones de medición y materiales de referencia;
h.
Valores inexactos de constantes y otros parámetros obtenidos de fuentes
externas y usados en los algoritmos de reducción de datos;
i.
Aproximaciones y suposiciones incorporadas en los métodos y procedimientos de
medición;
j.
Variaciones en observaciones repetidas del mensurando bajo condiciones
aparentemente iguales.
Estas fuentes no son necesariamente independientes, y algunas
de las fuentes desde (a) hasta (i) pueden contribuir a la fuente (j). Por
supuesto, un efecto sistemático no reconocido no puede ser tomado en cuenta en
la evaluación de la incertidumbre del resultado de una medición pero contribuye
a su error.”
5.2 Laboratorio de Calibración: Laboratorio que provee servicios de
calibración y medición.
5.3 CIPM MRA: Acuerdo de Reconocimiento Mutuo del Comité Internacional de
Pesas y Medidas (CIPM).
5.4 ILAC: Cooperación Internacional de Acreditación de Laboratorios.
5.5 Capacidad de Medición y Calibración (CMC): Es una capacidad de medición y/o
calibración disponible a los clientes bajo condiciones normales:
a.
Como se describe en el alcance de acreditación concedido al laboratorio por un
signatario del acuerdo de ILAC, o
b.
Como se publica en la base de datos de intercomparaciones clave (KCDB) del BIPM
del CIPM MRA (consultar en la dirección http://kcdb.bipm.org/AppendixC/default.asp)
(esto corresponde para laboratorios nacionales o designados)
Las CMC deben declararse con la mejor incertidumbre de
medición, que puede lograr el laboratorio para el método de calibración
acreditado o en proceso de acreditación.
5.6 Mejor incertidumbre de medición: Es la incertidumbre más pequeña que
puede obtener el laboratorio de calibración, para el método de calibración
acreditado o en proceso de acreditación, tomando en cuenta las siguientes
fuentes, cuando correspondan:
a.
Sus equipos de medición y auxiliares
b.
Sus patrones, que relacionan el servicio con la cadena de trazabilidad
c. Su personal calificado y competente
d. Sus condiciones ambientales
e. Sus Instalaciones apropiadas
f. Su procedimiento de calibración
g. Otras magnitudes de influencia
h. Desempeño del mejor equipo a calibrar.
5.7 Mejor equipo a
calibrar: Patrón o instrumento de mejores condiciones y desempeño metrológicos
(ejemplo: el equipo que tenga la mejor resolución, mejor estabilidad, menor
deriva entre otros) disponible comercialmente o para los clientes del
laboratorio, y que calibra el laboratorio rutinariamente en condiciones
normales de operación dentro de su alcance acreditado.
5.8 Para cualquier otra
definición requerida consultar el Vocabulario Internacional de Metrología _ Conceptos
fundamentales y generales, y términos asociados (VIM), en su versión vigente
que puede ser consultada en la página de
5.9 Laboratorio clínico: Laboratorio de ensayo dedicado
al análisis biológico, microbiológico, inmunológico, químico,
inmunohematológico, hematológico, biofísico, citológico, patológico, o de otro
tipo, de materiales derivados del cuerpo humano, con el objeto de proveer
información para el diagnóstico, prevención y tratamiento de enfermedades, o la
evaluación del estado de salud de seres humanos, que puede proveer un servicio
de asesoramiento que abarque todos los aspectos de la investigación de
laboratorio, incluyendo la interpretación de resultados y consejo sobre una
apropiada investigación ulterior.
5.10 Error de medida
máximo permitido (EMP): (conocido también como Error Total, error máximo
tolerable) valor extremo del error de medida, con respecto al valor de
referencia de una magnitud conocida, permitido por especificaciones o
regulaciones para una medida, un instrumento de medida o un sistema de medida
determinados.
6. CRITERIOS PARA
LABORATORIOS DE CALIBRACIÓN
6.1 Todos los laboratorios
de calibración deben estimar la incertidumbre para todas las calibraciones y
mediciones incorporadas en el alcance acreditado o por acreditar.
6.2 Los laboratorios de
calibración acreditados o en proceso de acreditación, deben estimar las
incertidumbres de medición y calibración, acorde con
6.3 Los laboratorios de
calibración deben:
6.3.1 Determinar su
Capacidad de Medición y Calibración (CMC).
6.3.2 Declarar en los
certificados de calibración, cuando aplique, las magnitudes de influencia con
su correspondiente incertidumbre.
6.3.3 Mantener evidencia
documentada que respalde sus declaraciones de incertidumbre, que incluya:
a. Memoria de cálculo.
b. Datos.
c. Procedimiento de estimación de la incertidumbre.
d. Demostración de la validez de los resultados de la estimación de la
incertidumbre.
6.4 No debe haber
ambigüedad en la expresión de
6.5 Se aceptan cómo
validos los siguientes métodos para la expresión de la incertidumbre en los
alcances de acreditación:
a. Un único valor, que sea válido en todo el ámbito de medición.
b. Un ámbito. En este caso el laboratorio de calibración debe demostrar que
mediante una interpolación adecuada se puede encontrar la incertidumbre de
valores intermedios.
c. Una función explicita del mesurando o parámetro
d. Una matriz donde los valores de la incertidumbre dependen de los valores
de los mensurandos y parámetros adicionales.
e. Una forma gráfica, que provea suficiente resolución en cada eje para
obtener al menos dos cifras significativas para la incertidumbre.
6.6. Un intervalo abierto,
por ejemplo “U < x” NO SON PERMITIDOS en la especificación de
incertidumbres.
6.7 La incertidumbre
cubierta por
6.8 Los laboratorios de
calibración deben evidenciar que pueden brindar calibraciones a sus clientes en
cumplimiento de lo declarado en el alcance de acreditación, por lo que las
incertidumbres de las mediciones deben ser iguales o mayores a las incorporadas
en las CMC del alcance de acreditación.
6.9 Los laboratorios de
calibración deben evidenciar que las incertidumbres de sus CMC, son
consistentes con las incertidumbres declaradas por sus proveedores de
trazabilidad.
6.10 Dentro de la
estimación de la incertidumbre de
- Repetibilidad
- Cuando sea posible,
contribuciones por reproducibilidad.
Lo anterior se debe
estimar tanto para el método como para el mejor equipo a calibrar, según
corresponda.
6.11 Los laboratorios de
calibración deben reportar en los certificados de calibración, la incertidumbre
de medición en cumplimiento de los siguientes requisitos:
6.11.1 Los resultados de
las calibraciones deben normalmente incluir el valor de la cantidad medida “y”
y la incertidumbre expandida asociada “U”. En los certificados de
calibración el resultado de la calibración debería ser reportado como “y ±
U” con sus respectivas unidades. Una presentación tabular de los
resultados de calibración puede utilizarse y la incertidumbre relativa
expandida U / |y| puede también ser reportada, si se considera
apropiado.
6.11.2 El factor de
cobertura y la probabilidad de cobertura deben ser declarados en el certificado
de calibración, junto con una nota aclaratoria con contenido similar al
siguiente:
“La incertidumbre
expandida reportada en el certificado de calibración, se declara como la
incertidumbre estándar de la medición multiplicada por un factor de cobertura k
que corresponde a una probabilidad de cobertura aproximadamente del 95%.”
Nota. Para incertidumbres
asimétricas otra representación de la incertidumbre “y ± U” puede
ser necesaria. Esto también es concerniente a casos cuando la incertidumbre es
determinada por simulación Monte Carlo o por el método de propagación de
distribución con unidades logarítmicas.
6.11.3 El valor numérico
de la incertidumbre expandida debe expresarse, a lo sumo, con dos cifras
significativas, correspondiendo los siguientes requisitos:
a. El valor numérico del resultado final, debe redondearse de forma tal que
sea concordante con el número de cifras significativas con que se expresa la
incertidumbre expandida de la calibración
b. Para el proceso de redondeo, las reglas usuales de redondeo de números
deben ser utilizadas, por ejemplo las descritas en la sección 7 de
Nota: Para mayores detalles
sobre redondeo, ver ISO 80000-1:2009.
6.11.4 La incertidumbre
declarada en el certificado de calibración debe incluir las componentes de
incertidumbre aportadas por el equipo del cliente, las cuales sustituyen las
componentes consideradas para el mejor equipo a calibrar, por lo tanto las
incertidumbres reportadas en los certificados de calibración deben ser mayores
o iguales a las declaradas en las CMC de los alcances de acreditación vigentes
y publicados en la página web del ECA.
Nota. Contribuciones aleatorias
que no puedan ser conocidas por el laboratorio, como por ejemplo la
incertidumbre de transporte del equipo del cliente, deberían normalmente estar
excluidas de la declaración de incertidumbre. Sin embargo, si un laboratorio
anticipa que
dichas contribuciones
tendrán un impacto significativo sobre la incertidumbre estimada por el
laboratorio, el cliente debería ser notificado de acuerdo con los requisitos de
revisión de los pedidos, ofertas y contratos de la norma de ISO/IEC 17025.
6.11.5 La definición de
CMC implica que los laboratorios de calibración NO DEBEN reportar
incertidumbres más pequeñas que las incertidumbres declaradas en las CMC del
alcance de acreditación. En caso que el laboratorio reporte incertidumbres
menores a las declaradas en el alcance de acreditación, las mismas deben
reportarse como servicios de calibración no acreditados y sin el uso del
respectivo símbolo de acreditación.
6.12 La incertidumbre de
medición para cada paso en la cadena de trazabilidad debe ser estimada (a
través de cálculos adecuados). Cuando un sistema particular de medición quede
fuera del alcance de esta Política, el laboratorio debe presentar un procedimiento
de estimación detallado generalmente aceptado. En ambos casos deben ser
declaradas las fuentes de incertidumbre y su tratamiento, a cada paso de la
cadena de trazabilidad, de tal manera que la incertidumbre estándar combinada
pueda ser calculada para la cadena completa. Estas incertidumbres deben estar
respaldadas matemáticamente y estarán representadas como incertidumbres
expandidas usando una probabilidad de cobertura adecuada y su factor de
cobertura correspondiente.
6.13 Cuando el laboratorio
requiera actualizar la incertidumbre de sus CMC debe presentar al ECA con la
solicitud de cambio la siguiente información:
a. Procedimiento, instructivo o documento para la estimación de la
incertidumbre
b. Hoja de cálculo, con los datos que respaldan las CMC del alcance
c. Certificado de calibración que respalde el mejor equipo a calibrar
d. Informe de validación del método actualizado, con respecto a la
incertidumbre de
6.14 Cuando el cambio en
la incertidumbre de
6.15 Cuando el cambio en
la incertidumbre de
7. CRITERIOS PARA
LABORATORIOS DE ENSAYO.
7.1 Los laboratorios de
ensayo deben poseer y aplicar procedimientos para estimar la incertidumbre de
medición asociada con los resultados de los ensayos o mediciones que realicen.
Así mismo, esta información debe estar disponible y ser lo suficientemente
clara para los usuarios.
7.2 Las fuentes que
contribuyen a la incertidumbre incluyen, pero no se limitan necesariamente, a
los patrones de referencia y los materiales de referencia utilizados, los
métodos y equipos utilizados, las condiciones ambientales, las propiedades y la
condición del ítem sometido al ensayo y el operador.
7.3 Para mayor información
consúltese
7.4 El grado de rigor
requerido en una estimación de la incertidumbre de la medición depende de
factores tales como:
a. los requisitos del método de ensayo;
b. los requisitos del cliente;
c. la existencia de límites estrechos en los que se basan las decisiones
sobre la conformidad con una especificación.
7.5 En aquellos casos en
los que un método de ensayo reconocido especifique límites para los valores de
las principales fuentes de incertidumbre de la medición y establezca la forma
de presentación de los resultados calculados, se considera que el laboratorio
ha satisfecho esta política si sigue el método de ensayo sin modificaciones,
las instrucciones para informar de los resultados y evidencie que con sus
condiciones, (equipos, patrones o materiales de referencia, condiciones ambientales
y su personal), puede obtener incertidumbres menores o iguales a los límites de
incertidumbre declarados en el método normalizado o reconocido.
7.6 Para los ensayos que
por sus características no se pueda estimar la incertidumbre, el Laboratorio
debe contar con procedimientos implementados para mantener bajo control todas
las variables de influencia.
7.7 Los laboratorios de
ensayo deben mantener evidencia documentada que soporte sus declaraciones de
incertidumbre, que incluya:
a. Memoria de cálculo.
b. Datos.
c. Procedimiento de estimación de la incertidumbre.
d. Demostración de la validez de los resultados de estimación de la
incertidumbre.
8. CRITERIOS PARA
LABORATORIOS CLÍNICOS
8.1 Los Laboratorios
Clínicos deben determinar la incertidumbre de los resultados. Cuando lo
anterior no sea pertinente ni posible, debe aportar evidencia objetiva que lo
justifique. Se deben tener en cuenta los componentes de incertidumbre que sean
de importancia.
NOTA: Las posibles fuentes
que pueden contribuir a la incertidumbre, son la toma y preparación de muestra,
selección de la alícuota de muestra, calibradores, materiales de referencia,
equipo usado, reactivos, magnitudes de entrada por ejemplo absorbancia,
condiciones ambientales, condición de la muestra y cambios de operador, entre
otras.
8.2 Para mayor información
consúltese
8.3 Para los análisis
clínicos, que por sus características no se pueda estimar la incertidumbre, el
Laboratorio debe identificar y mantener bajo control todas las variables de
influencia.
8.4 Los laboratorios
clínicos deben mantener evidencia documentada que soporte sus declaraciones de
incertidumbre, que incluya:
a. Memoria de cálculo.
b. Datos primarios
c. Procedimiento de estimación de la incertidumbre.
d. Demostración de la validez de los resultados de estimación de la
incertidumbre por la comparación con el error de medida máximo permitido (EMP)
9. TRANSITORIO
9.1 Para la aplicación de
los requisitos de la sección 6, se brinda un periodo de transición de un 1 mes
a partir de la publicación de este documento en el Diario Oficial
9.2 Para cumplir con el
requisito anterior y respaldar los cambios de las CMC, los laboratorios deben
entregar al ECA:
a. Procedimiento, instructivo o documento para la estimación de la
incertidumbre
b. Hoja de cálculo, con los datos que respaldan las CMC del alcance
c. Certificado de calibración que respalde el mejor equipo a calibrar
d. Informe de validación del método actualizado, con respecto a la
incertidumbre de
Para realizar los cambios
en los alcances de acreditación se seguirá lo establecido en los requisitos
6.14 y 6.15 de esta política.
9.3 Para la aplicación de
los requisitos de la sección 8, se brinda un periodo de transición de un mes a
partir de la publicación de este documento en el Diario Oficial
10. BIBLIOGRAFÍA
- ILAC-P14:12/2010 ILAC Policy for Uncertainty in Calibration
- OIML/V2 Vocabulario Internacional de Términos Básicos de Metrología,
Segunda edición 2009.
- Guía BIPM/ISO para la expresión de la incertidumbre en mediciones (GUM).
- Norma INTE-ISO/IEC 17025:2005 Requisitos generales para la competencia de
laboratorios de ensayo y calibración.
10. ANEXOS: EJEMPLOS DE
ESTIMACIÓN DE INCERTIDUMBRE:
Se les recuerda que las
estimaciones de incertidumbre deben realizarse conforme a
Ejemplo 1: Determinación
del valor de la actividad del ión hidronio en una muestra incógnita:
Se desea determinar el
valor de la actividad del ion hidronio, en una muestra incógnita, realizando la
curva de pH con dos disoluciones amortiguadoras de 4,00 ± 0,02 y 7,00 ± 0,02, a
Modelo matemático 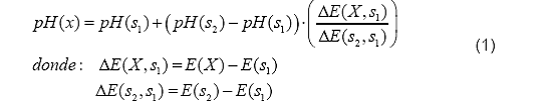
Donde:
pH(s1) = valor de pH de la
disolución amortiguadora 1
pH(s2) = valor de pH de la
disolución amortiguadora 2
E(X) = potencial en mV, de
la muestra
E(s1) = potencial en mV,
de la disolución amortiguadora 1
E(s2) = potencial en mV,
de la disolución amortiguadora 2
Resultados experimentales
pH(s1)= 4,00 E(s1)=167,9
mV
pH(s2)= 7,00 E(s2)=- 4,0
mV
E(X)= 158,2 mV
A partir de los datos
anteriores determinó que el valor de la actividad de ion hidronio en la muestra
es de: pH(X) = 4,169
Las variables de entrada
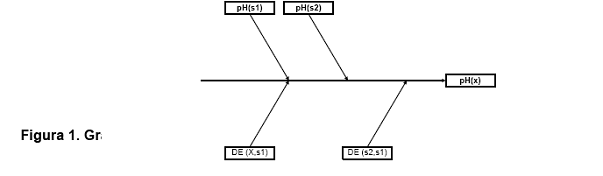
pueden ser observadas en la figura 1.
 Para determinar la
incertidumbre estándar de la determinación, utilizamos la siguiente fórmula:
Para determinar la
incertidumbre estándar de la determinación, utilizamos la siguiente fórmula:
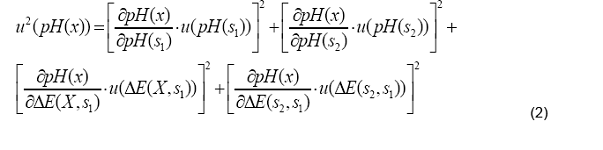 Donde son
los coeficientes de sensibilidad
Donde son
los coeficientes de sensibilidad
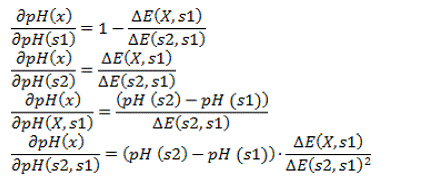
Por lo tanto, al sustituir
los resultados experimentales en las ecuaciones de coeficientes de
sensibilidad, tenemos:

Para determinar la
incertidumbre estándar de cada variable, debo considerar la información
suministrada por el fabricante o determinada experimentalmente, en nuestro caso
específico solamente consideramos al fabricante. No existe información
suficiente, que me indique que la tolerancia indicada por el fabricante de las
soluciones amortiguadoras y la tolerancia del potenciómetro, tienen alguna
distribución específica, por lo tanto considero que las mismas tienen
distribución rectangular.
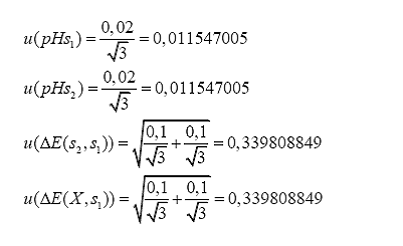
Finalmente, sustituyo y
obtengo la incertidumbre estándar

Ejemplo 2. Cálculo de
incertidumbre asociado a las contribuciones sobre una magnitud obtenida por
medición directa.
Determinación de la
incertidumbre combinada asociada a una determinación de masa en una balanza
analítica digital con resolución de 0,5 mg.
Indicación del instrumento
m =
Contribuciones a la
incertidumbre:
a. incertidumbre estándar
por calibración:
Tolerancia por calibración
(linealidad) =
Distribución = rectangular
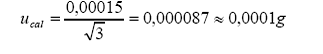
b. incertidumbre estándar
por lectura en escala digital: Tolerancia por lectura (resolución digital) =0,0005 g
Distribución = rectangular
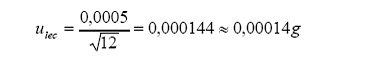
Cálculo de incertidumbre:
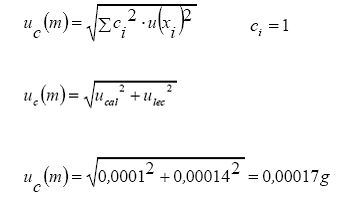
Reporte de resultado
![]()
Ejemplo 3: Cálculo de
incertidumbre asociado a las contribuciones sobre una magnitud obtenida por
medición directa.
Ejemplo:
Determinación de la
incertidumbre combinada asociada a la operación de medición y vertido de un
volumen de 10,0 mL utilizando una pipeta graduada con capacidad máxima de 20,0
mL.
![]()
Contribuciones a la
incertidumbre:
a. Incertidumbre estándar
por tolerancia del fabricante a 20 °C:
Tolerancia por calibración
= 0,03 mL
Distribución = triangular
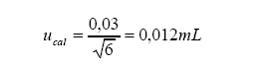
b. incertidumbre estándar
por lectura de la escala graduada:
La incertidumbre asociada
al proceso de lectura de la escala de una pipeta graduada se determina a partir
de la resolución de la escala graduada.
Resolución de la escala:
Mínima división de escala
= 0,02 mL
Factor de ojo = 2
Distribución = rectangular
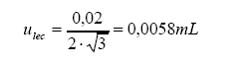
c. Incertidumbre estándar
por diferencia entre la temperatura de calibración (
Variación máxima de
temperatura alrededor de
Coeficiente de expansión
térmica del agua = 2,110-4 °C-1
Distribución = rectangular
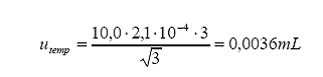
d. Repetibilidad:
s=0,025 (desviación
estándar a partir de 7 réplicas)

Cálculo de incertidumbre
combinada:
![]()
Reporte de resultado:
Vpipeta = 10,00 mL, uc =
0,017 mL
Ejemplo 4: Cálculo de la
incertidumbre asociada a una cantidad obtenida mediante una operación
fundamental tipo multiplicación y/o división.
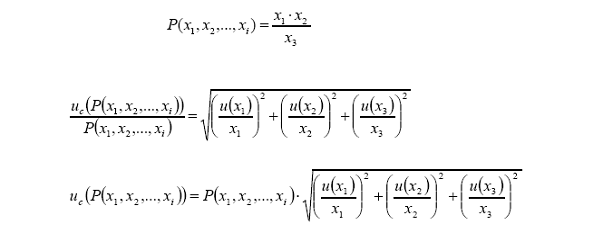
Ejemplo:
Determinación de la
incertidumbre asociada a la concentración de una disolución de KCl obtenida al
disolver

Contribuciones a la
incertidumbre:
a. Incertidumbre estándar asociada a la balanza analítica.
incertidumbre estándar por
calibración:
Tolerancia por calibración
(linealidad) =
Distribución = rectangular
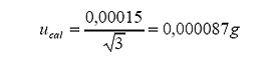
Incertidumbre estándar por
lectura en escala digital: Incertidumbre por lectura (resolución digital)
Distribución = rectangular
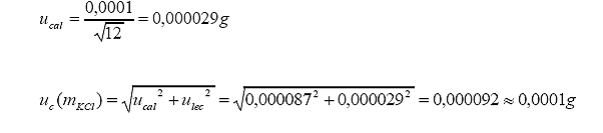
b. Incertidumbre estándar asociada al peso molecular.


c. Incertidumbre estándar asociada a la pureza.
Tolerancia del fabricante
= 0,005 (98,0 0,5 %)
Distribución = rectangular
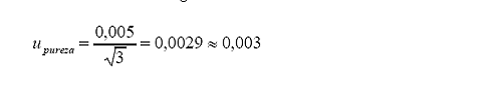
d. Incertidumbre estándar asociada al balón aforado.
Incertidumbre estándar por
calibración del fabricante a 20 °C:
Tolerancia por calibración
= 0,1 mL
Distribución = triangular
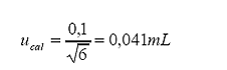
incertidumbre estándar por
lectura de la marca de aforo:
Reproducibilidad = 0,035
(desviación estándar a partir de 5 réplicas)
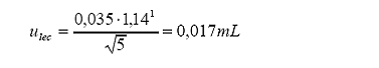
1 estadístico t para 4
grados de libertad y 68% de confianza.
Incertidumbre estándar por
diferencia entre la temperatura de calibración (
Variación máxima de
temperatura alrededor de
Coeficiente de expansión
térmica del agua = 2,110-4 °C-1
Distribución = rectangular
Ejemplo 6: Determinación
de la concentración promedio de cierto componente x en un alimento mediante la
técnica de espectrofotometría ultravioleta. Luego de seguir el procedimiento
indicado, el cálculo de la concentración del componente x se obtiene según la
fórmula:
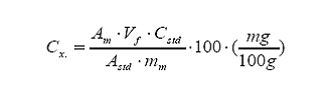
En términos de la
absorbancia, masa y volumen final de la muestra.
Los resultados obtenidos
para tres muestras del alimento se indican en la siguiente tabla:
|
# muestra |
mm/g |
Am |
|
1 |
25,2356 |
0,385 |
|
2 |
27,4578 |
0,421 |
|
3 |
26,1167 |
0,393 |
1. Cálculo de
concentración y análisis de incertidumbre para la muestra #1:


2. Cálculo e incertidumbre
de la concentración promedio del componente x:
Un procedimiento de
cálculo similar aplicado a las otras dos muestras permite obtener los
resultados resumidos en la siguiente tabla:
|
# muestra |
Cx /gmg100 |
uc(Cx) |
|
1 |
209,1 |
6,7 |
|
2 |
210,2 |
6,7 |
|
3 |
206,2 |
6,6 |
De donde se obtiene el
valor de la concentración promedio con su respectiva incertidumbre estándar:
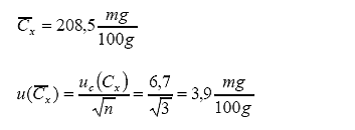
Para completar el cálculo
de incertidumbre del valor promedio se debe de tomar en cuenta la contribución
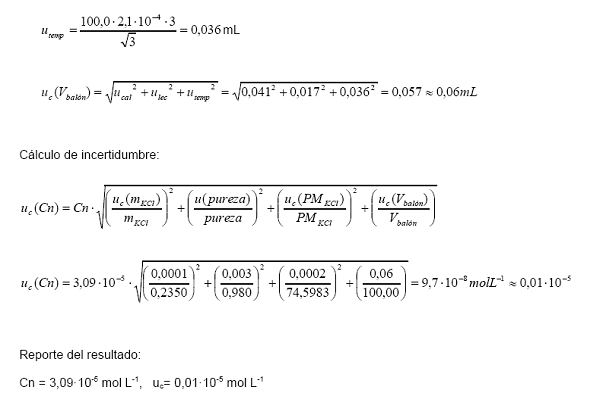
por repetibilidad. Esta se calcula en términos del desvío estándar de las
réplicas respecto del valor promedio:
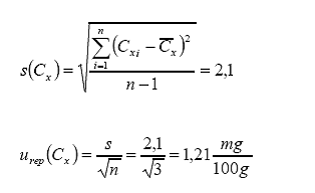
Ahora el cálculo de la
incertidumbre estándar combinada total del valor promedio será ahora:
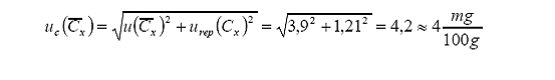
Reporte de resultado:
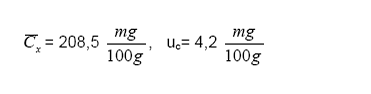

11. CONTROL DE CAMBIOS
|
Motivo: |
Modificación de
documento |
|
Refiérase a la solicitud
de elaboración o modificación del documento número 2012-150 |
|
|
Observaciones Objetivo y alcance se
incorpora la referencia a laboratorios clínicos Apartado 5 inciso 5.6 se
modifican las viñetas”…
e. Sus Instalaciones apropiadas
f. Su procedimiento de calibración
g. Otras magnitudes de influencia
h. Desempeño del mejor equipo a calibrar 5.7 Mejor equipo a
calibrar: Patrón o instrumento de mejores condiciones y desempeño
metrológicos (ejemplo: el equipo que tenga la mejor resolución, mejor
estabilidad, menor deriva entre otros) disponible comercialmente o para los
clientes del laboratorio, y que calibra el laboratorio rutinariamente en
condiciones normales de operación dentro de su alcance acreditado. Semodifican de manera
completa los apartado 5.9 y 5.10 de la siguiente manera: 5.9 Laboratorio clínico:
Laboratorio
de ensayo dedicado al análisis biológico, microbiológico, inmunológico,
químico, inmunohematológico, hematológico, biofísico, citológico, patológico,
o de otro tipo, de materiales derivados del cuerpo humano, con el objeto de
proveer información para el diagnóstico, prevención y tratamiento de
enfermedades, o la evaluación del estado de salud de seres humanos, que puede
proveer un servicio de asesoramiento que abarque todos los aspectos de la
investigación de laboratorio, incluyendo la interpretación de resultados y
consejo sobre una apropiada investigación ulterior. 5.10 Error de medida
máximo permitido (EMP): (conocido también como Error Total, error máximo
tolerable) valor extremo del error de medida, con respecto al valor de
referencia de una magnitud conocida, permitido por especificaciones o
regulaciones para una medida, un instrumento de medida o un sistema de medida
determinados. Inciso 6.3.2 Declarar en
los certificados de calibración, cuando aplique, las magnitudes de influencia
con su correspondiente incertidumbre. Modificación de los
apartado 6.9 y 6.10 6.9 Los laboratorios de
calibración deben evidenciar que las incertidumbres de sus CMC, son
consistentes con las incertidumbres declaradas por sus proveedores de
trazabilidad. 6.10 Dentro de la
estimación de la incertidumbre de - Repetibilidad - Cuando sea posible,
contribuciones por reproducibilidad. Lo anterior se debe
estimar tanto para el método como para el mejor equipo a calibrar, según
corresponda. Incisos 6.11.1 y 6.11.2,
6.12 se incorporan los conceptos de probabilidad de cobertura. Se modifican de manera
completa los incisos 6.13, 6.14 y 6.15 Se incorpora el apartado
8 Criterios para laboratorios Clínicos Apartado 9 describe el transitorio para aplicación de la política. |
|