N° 40003-S
EL
PRESIDENTE DE LA REPÚBLICA
Y EL
MINISTRO DE SALUD
Con fundamento en
las atribuciones que les confieren los artículos 50, 140 incisos 3) y 18) y 146
de la Constitución Política; 25 inciso 1), 27 inciso 1) y 28 inciso 2) acápite
b) de la Ley N° 6227 del 2 de mayo de 1978 “Ley General de la Administración
Pública”; 1 y 2 de la Ley N 0 5395 del 30 de octubre de 1973 Ley General de
Salud” y 2 y 6 de la Ley N° 5412 del 8 de noviembre de 1973 “Ley Orgánica del
Ministerio de Salud”
CONSIDERANDO
Io* Que es función esencial del Estado, velar
por la protección de la salud de la población.
2o- Que el Estado
tiene también la responsabilidad de garantizar el bienestar de los ciudadanos,
sin que por ello se obstaculicen innecesariamente las condiciones de
competitividad para el desenvolvimiento de la actividad económica del país,
3o- Que existe un
creciente número de productos comercializados en calidad de alimentos que
contienen fuentes concentradas de nutrientes u otros componentes y que se presentan
con la finalidad de complementar la ingesta de los mismos en la dieta.
4o- Que mediante
decreto ejecutivo N° 36134—S del 10 de mayo del 2010 “Reglamento RTCR 436:2009
Suplementos a la Dieta. Requisitos de Registro Sanitario, Importación,
Desalmacenaje, Etiquetado y Verificación”, publicado en La Gaceta N 186 del 24
de setiembre del 2010, se estableció la clasificación para fines de registro
sanitario, de dichos productos como suplementos a la dieta y además se
especificaron los requisitos relativos a su composición, etiquetado y
comercialización, de manera que se promueva un correcto uso de los mismos por
parte de la población.
5o- Que en la
aplicación de! Decreto Ejecutivo No. 36134-S citado en el considerando
anterior, las autoridades de salud detectaron que existen lagunas jurídicas que
deben ser subsanadas, por lo que se hace necesario reformarlo, para hacer su
cumplimiento más ágil y efectivo.
6o- Que de
conformidad con lo establecido en el artículo 12 bis del Decreto Ejecutivo No.
37045 de 22 de febrero de 2012 y su reforma “Reglamento a la Ley de Protección
al Ciudadano del Exceso de Requisitos y Trámites Administrativos”, esta
regulación cumple con los principios de mejora regulatoria, de acuerdo con el
informe N° DMRAR- INF-003-16 de fecha 5 de octubre del 2016, emitido por la
Dirección de Análisis Regulatorio del Ministerio de Economía, Industria y
Comercio.
Por tanto,
DECRETAN:
Modificación
y Adición ai Decreto Ejecutivo N° 36134-S del 10 de
mayo del 2010
"RTCR
436:2009 Suplementos a la Dieta. Requisitos de Registro Sanitario,
Importación,
Desalmacenaje, Etiquetado y Verificación”, publicado en La Gaceta
N° 186
del 24 de setiembre del 2010.
Artículo Io- Modifiqúense los
incisos Io, 2o acápites 1), 2) y 3), 3o acápite 3.15,
5o, 6o, T acápites 7.1, 7.2, 7.5, 7.6, 7.8, 8o acápite a), 9o acápites
9.1, 9.1.4.Í) y 12 del artículo Io, así como el Anexo
2 del Decreto Ejecutivo N° 36134-S del 10 de mayo del 2010 “Reglamento RTCR
436:2009 Suplementos a la Dieta, Requisitos de Registro Sanitario, Importación,
Desalmacenaje, Etiquetado y Verificación”, publicado en La Gaceta N° 186 del 24
de setiembre del 2010, para que se lean de la siguiente manera:
“Io—Objetivo y
ámbito de aplicación. El objetivo
de este reglamento es establecer las condiciones y los requisitos para el
registro sanitario, importación, desalmacenaje,
etiquetado y verificación de los suplementos alimenticios.
Este reglamento se aplicará a todos los
suplementos a la dieta que se comercialicen en el territorio nacional.
Los alimentos para regímenes especiales no
se consideran parte de este reglamento.
2o—Referencias. Este reglamento se
complementa con los siguientes:
1) Decreto Ejecutivo N° 37280-COMEX-MEIC del
18 de junio del 2012 “Publica Resolución N° 280-2012 (COMIECO-LXII) de fecha 14
de mayo de 2012 y su Anexo: "Reglamento Técnico Centroamericano RTCA
67.01.07:10 Etiquetado General de los Alimentos Previamente Envasados" (Preenvasados)", publicado en el Alcance N° 133 a La
Gaceta N° 180 del 18 de septiembre de 2012.
2) Decreto Ejecutivo N° 37295-COMEX-MEIC-S
del 18 de junio del 2012 “Publica Resolución N° 281-2012 (COMIECO-LXII) de 14
de mayo del 2012, modificaciones al Reglamento Técnico Centroamericano RTCA
67.01.60:10 "Etiquetado Nutricional de Productos Alimenticios Preenvasados para Consumo Humano para población a partir de
3 años”, publicado en el Alcance N° 138 a La Gaceta N° 185 del 25 de septiembre
de 2012.
3) Decreto Ejecutivo N° 39472-S del 18 de
enero del 2016 “Reglamento General para Autorizaciones y Permisos Sanitarios de
Funcionamiento Otorgados por el Ministerio de Salud”, publicado en el Alcance
Digital N° 13 a La Gaceta N° 26 del 8 de febrero del 2016.
( ...)
3°-Definiciones. Para la aplicación del presente Reglamento
se entenderá por:
( . . . )
3.15) Suplemento a la dieta: Es aquel
producto alimenticio cuya Finalidad es suplir, adicionar, complementar o
incrementar la dieta y la ingestión de nutrientes en la alimentación diaria. Se
presenta como fuente concentrada de nutrientes y/u otras sustancias con efecto
fisiológico o nutricional, solos o combinados, incluyendo compuestos tales como
vitaminas, minerales, proteínas, aminoácidos, plantas, concentrados y extractos
de plantas, probióticos, sustancias bioactivas u otros nutrientes y sus derivados. Pueden
comercializarse en diferentes formas tales como comprimidos, cápsulas,
tabletas, polvo, soluciones, jarabes entre otros, dosificados, para ser
ingeridos exclusivamente por vía oral y no como alimentos convencionales. Su
consumo no deberá representar un riesgo para la salud.
“5o—De la administración del Registro
Sanitario de los Suplementos a la dieta. El Ministerio de Salud, a través
de la Dirección de Regulación de Productos de Interés Sanitario, será la
autoridad competente de otorgar, denegar, suspender o cancelar el registro de
los suplementos a la dieta.”
6°-Aspectos generales sobre el registro
sanitario de Suplementos a la dieta.
Para comercializar, importar y distribuir
los suplementos a la dieta, se debe contar previamente con el registro
sanitario vigente, de acuerdo con los requisitos establecidos en este
reglamento.
El registro no excluirá la responsabilidad
plena de las personas físicas o jurídicas que hayan fabricado, elaborado o
importado el suplemento alimenticio, en cuanto a su garantía sanitaria, calidad
nutritiva e inocuidad. El Ministerio otorgará el registro de un suplemento a la
dieta, una vez que haya realizado el análisis de la información legal, técnica
y científica.
El Ministerio podrá reconocer los registros
de los suplementos a la dieta, registrados en los países que el Ministerio
considere cuentan con normativa similar o superior a la nuestra. La lista de
países, así como el procedimiento y requisitos para este reconocimiento serán
publicados vía reglamento.
Se exceptúan del registro las muestras sin valor
comercial de suplementos a la dieta.
7o—Requisitos para el registro sanitario
de Suplementos a la dieta.
Para el registro sanitario de suplementos a
la dieta, el interesado deberá ingresar al sistema regístrelo del Ministerio,
la siguiente información:
7.1. ) Formulario de solicitud de registro,
firmado digitaimente por el titular del producto o su
representante legal.
7.2. ) Permiso de funcionamiento vigente
(este requisito se verificará internamente en el Ministerio de Salud). En caso
de productos importados, deberá presentar el Certificado de Libre Venta o su
equivalente emitido por la entidad competente que acredite que el producto
cuenta con la autorización respectiva para su venta, uso o consumo en el país
de origen o procedencia, de acuerdo con la legislación de cada país. Este
certificado debe ser legalizado o apostillado, podrá incluir uno o varios
productos y tendrá la validez que le otorgue la entidad competente del país que
lo emite, en los casos que no se indique la vigencia, ésta será de 2 años para
efecto del trámite de registro, a partir de la fecha de emisión. En caso de que
el certificado venga en idioma diferente al español debe venir acompañado de la
respectiva traducción oficial.
(...)
7.5) Fórmula cualitativa y cuantitativa del
producto emitida por el fabricante, expresada en unidades conforme a la Ley del
Sistema Internacional de Medidas.
En caso de especies vegetales se debe
indicar nombre científico y parte de la planta utilizada. Para suplementos con probióticos indicar nombre científico y código de registro
de la bacteria, así como la dosis que tiene el suplemento.
7.6) Etiqueta original o proyecto de
etiqueta, en conformidad con los requisitos establecidos en el numeral 9 del
presente reglamento. Si la etiqueta original se encuentra en un idioma
diferente al español, deberá presentar la respectiva traducción y la etiqueta
complementaria correspondiente.
( . . . )
7.8) Indicar la referencia o metodología
analítica utilizada para verificar la presencia de los nutrientes o componentes
contenidos en el suplemento a la dieta.
( . . . )
8o- Concentraciones mínimas y máximas de
vitaminas y minerales.
a) Los suplementos a la dieta con vitaminas
y minerales, deben contener no menos de las concentraciones especificadas en el
anexo 1 para las vitaminas y los minerales que estén en el suplemento. Dichas
concentraciones corresponden al 20% de las RDI de Estados Unidos de América.
Los suplementos a la dieta que contengan algunas vitaminas o minerales cuya
concentración sea inferior a los valores mínimos establecidos en el anexo 1, se
podrán registrar como suplementos pero no podrá indicarse dentro del nombre o
la función la palabra suplemento.
En caso de que las concentraciones de todas
las vitaminas y minerales sean inferiores al nivel mínimo establecido en el
anexo 1, el producto no se puede registrar como suplemento a la dieta.
( . . . )
9. Requisitos del etiquetado:
9.1) Las etiquetas de los suplementos a la
dieta, deberán cumplir con lo estipulado en el Decreto Ejecutivo N° 37280.
Resolución N° 280-2012 (COMIECO-LXII) de fecha 14 de mayo de 2012 y su Anexo:
"Reglamento Técnico Centroamericano RTCA 67.01.07:10 Etiquetado General de
los Alimentos Previamente Envasados" (Preenvasados)";
así como con el Decreto Ejecutivo N° 37295. Resolución N° 281-2012
(COMIECO-LXII) de 14 de mayo del 2012, modificaciones al Reglamento Técnico
Centroamericano RTCA 67.01.60:10 "Etiquetado Nutricional de Productos
Alimenticios Preenvasados para Consumo Humano para
población a partir de 3 años. Adicionalmente deberán cumplir con lo siguiente:
( . . . )
9.1.4) Incluir las siguientes leyendas o
frases equivalentes:
( . . . )
f) Los suplementos a la dieta que contengan cafeína, deberán cuantificar
dicho ingrediente e incluir la leyenda: “NO SE RECOMIENDA EL CONSUMO DE ESTE
PRODUCTO POR PERSONAS SENSIBLES A LA CAFEÍNA.”
“12. Renovación del registro sanitario.
La renovación del registro de los
suplementos alimenticios, deberá gestionarse previo a la caducidad del mismo.
Para ello se deberá ingresar en el sistema regístrelo del Ministerio una
declaración jurada firmada por el representante legal en forma digital, en la
que manifieste que se mantienen las condiciones e información del registro
sanitario vigente. Además, se deberá presentar certificado de libre venta o su
equivalente y certificado de buenas prácticas de manufactura, según se detalla
en el apartado 7u de este reglamento."
"Anexo
2
Concentraciones
máximas diarias de vitaminas y minerales
en
suplementos a la dieta
(Normativo)
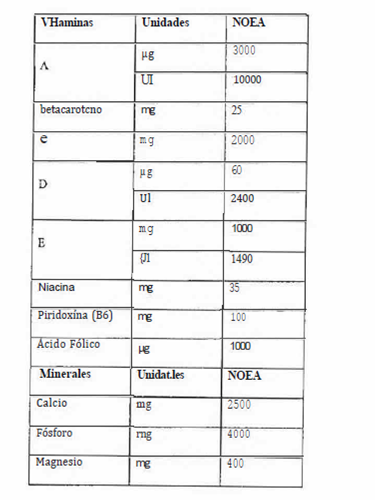
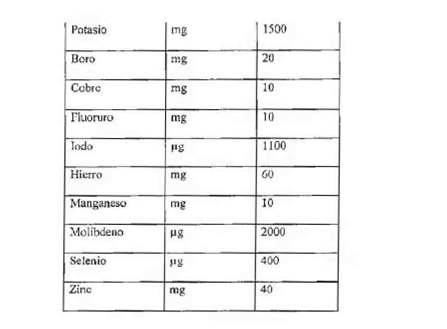
Fuentes:
Jonh N. Hathcock, Ph.D. Safety of vitamin and
mineral Supplements. Safe Levels Identified by risk Assessment. Abril 2004.
Food Supplements Europe. Risk management approaches
to the setting of maximum levels of vitamins and minerals in food supplements
for adults and for children aged 4-10 years. Julio 2014