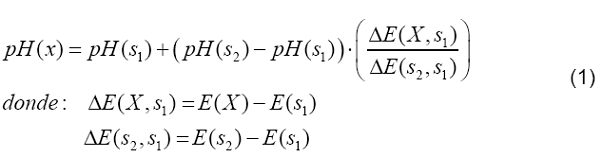
10.
ANEXOS: EJEMPLOS DE ESTIMACIÓN DE INCERTIDUMBRE:
Se
les recuerda que las estimaciones de incertidumbre deben realizarse conforme a
la Guía GUM, se adjuntan ejemplos de estimación de incertidumbre.
Ejemplo
1: Determinación del valor de la actividad del ión hidronio en una muestra incógnita:
Se
desea determinar el valor de la actividad del ion hidronio, en una muestra incógnita,
realizando la curva de pH con dos disoluciones amortiguadoras de 4,00 ± 0,02 y
7,00 ± 0,02, a 25 °C, considerando solamente los aportes a la incertidumbre,
producto del modelo matemático.
Modelo
matemático
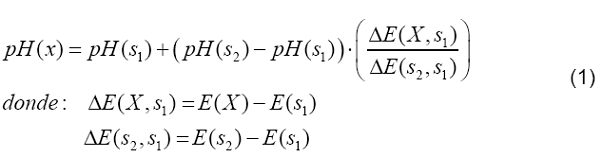
Donde:
pH(s1)
= valor de pH de la disolución amortiguadora 1
pH(s2)
= valor de pH de la disolución amortiguadora 2
E(X)
= potencial en mV, de la muestra
E(s1)
= potencial en mV, de la disolución amortiguadora 1
E(s2)
= potencial en mV, de la disolución amortiguadora 2
Resultados
experimentales
pH(s1)=
4,00
s1)=167,9 mV
pH(s2)=
7,00
s2)=- 4,0 mV
E(X)=
158,2 mV
A
partir de los datos anteriores determinó que el valor de la actividad de ion
hidronio en la muestra es de: pH(X) = 4,169
Las
variables de entrada pueden ser observadas en la figura 1
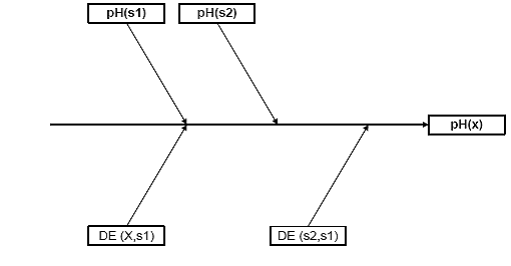
Figura
1. Gráfico de causa- efecto, para el modelo matemático (1)
Para
determinar la incertidumbre estándar de la determinación, utilizamos la
siguiente fórmula:
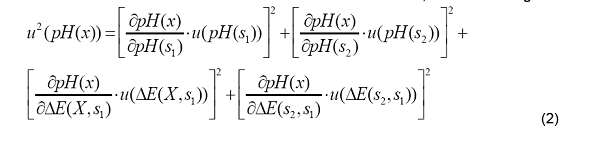
Donde
son los coeficientes de sensibilidad
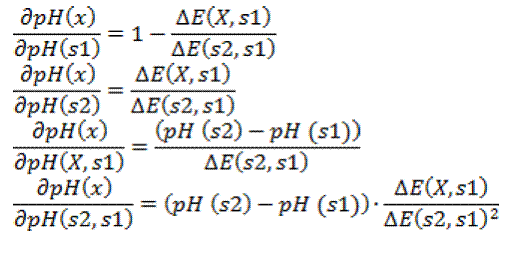
Por
lo tanto, al sustituir los resultados experimentales en las ecuaciones de
coeficientes de sensibilidad, tenemos:
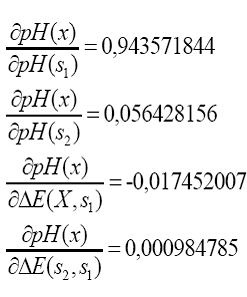 12121()
12121()
Para
determinar la incertidumbre estándar de cada variable, debo considerar la
información suministrada por el fabricante o determinada experimentalmente, en
nuestro caso específico solamente consideramos al fabricante. No existe
información suficiente, que me indique que la tolerancia indicada por el
fabricante de las soluciones amortiguadoras y la tolerancia del potenciómetro,
tienen alguna distribución específica, por lo tanto considero que las mismas
tienen distribución rectangular.
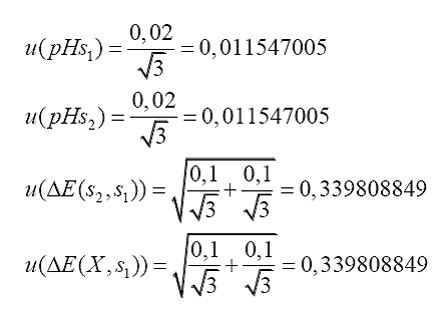
Finalmente,
sustituyo y obtengo la incertidumbre estándar

Ejemplo
2. Cálculo de incertidumbre asociado a las contribuciones sobre una magnitud
obtenida por medición directa.
Determinación
de la incertidumbre combinada asociada a una determinación de masa en una
balanza analítica digital con resolución de 0,5 mg.
Indicación
del instrumento
m
= 2,3050 g
Contribuciones
a la incertidumbre:
a.
incertidumbre estándar por calibración:
Tolerancia
por calibración (linealidad) = 0,00015 g
Distribución
= rectangular
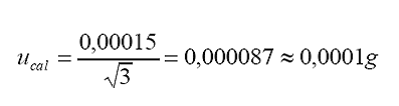
b.
incertidumbre estándar por lectura en escala digital:
Tolerancia
por lectura (resolución digital) =0,0005 g
Distribución
= rectangular
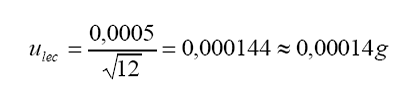
Cálculo
de incertidumbre:
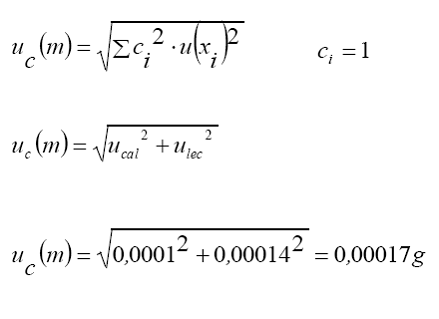
Reporte
de resultado:
m
= 2,3050 g,
uc = 0,00017 g
Ejemplo
3: Cálculo de incertidumbre asociado a las contribuciones sobre una magnitud
obtenida
por medición directa.
Ejemplo:
Determinación
de la incertidumbre combinada asociada a la operación de medición y vertido de
un volumen de 10,0 mL utilizando una pipeta graduada con capacidad máxima de
20,0 mL.
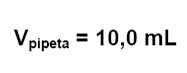
Contribuciones
a la incertidumbre:
a.
Incertidumbre estándar por tolerancia del fabricante a 20 °C:
Tolerancia
por calibración = . 0,03 mL
Distribución
= triangular
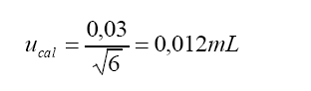
b.
incertidumbre estándar por lectura de la escala graduada:
La
incertidumbre asociada al proceso de lectura de la escala de una pipeta graduada
se determina a partir de la resolución de la escala graduada.
Resolución
de la escala:
Mínima
división de escala = 0,02 mL
Factor
de ojo = 2
Distribución
= rectangular
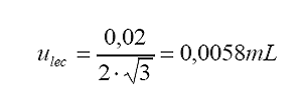
c.
Incertidumbre estándar por diferencia entre la temperatura de calibración (20
°C) y la temperatura de trabajo:
Variación
máxima de temperatura alrededor de 20 °C = .3 °C
Coeficiente
de expansión térmica del agua = 2,1.10-4 °C-1
Distribución
= rectangular
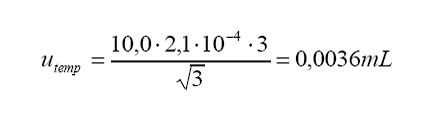
d.
Repetibilidad:
s=0,025
(desviación estándar a partir de 7 réplicas)
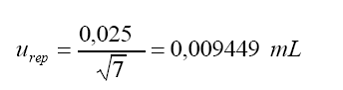
Cálculo
de incertidumbre combinada:
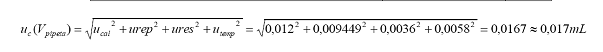
Reporte
de resultado:
Vpipeta
= 10,00 mL, uc = 0,017 mL
Ejemplo
4: Cálculo de la incertidumbre asociada a una cantidad obtenida mediante una
operación
fundamental tipo multiplicación y/o división.
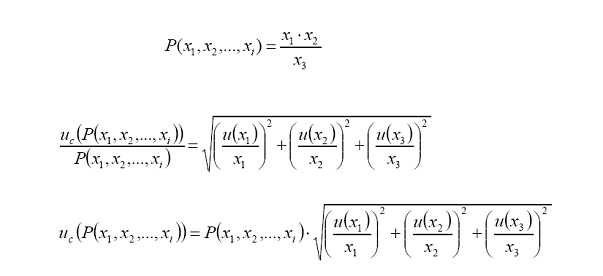
Ejemplo:
Determinación
de la incertidumbre asociada a la concentración de una disolución de KCl
obtenida al disolver 0,2350 g de KCl en balón aforado de 100,0 mL.

Contribuciones
a la incertidumbre:
a.
Incertidumbre estándar asociada a la balanza analítica.
incertidumbre
estándar por calibración:
Tolerancia
por calibración (linealidad) = 0,00015 g
Distribución
= rectangular
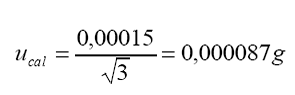
Incertidumbre
estándar por lectura en escala digital:
Incertidumbre
por lectura (resolución digital)
Distribución
= rectangular
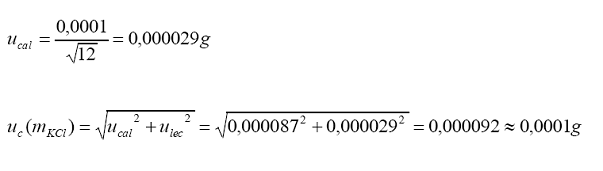
b.
Incertidumbre estándar asociada al peso molecular.

c.
Incertidumbre estándar asociada a la pureza.
Tolerancia
del fabricante = 0,005 (98,0 . 0,5 %)
Distribución
= rectangular
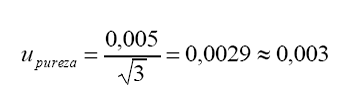
d.
Incertidumbre estándar asociada al balón aforado.
Incertidumbre
estándar por calibración del fabricante a 20 °C:
Tolerancia
por calibración = .0,1 mL
Distribución
= triangular
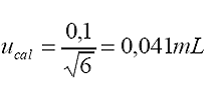
incertidumbre
estándar por lectura de la marca de aforo:
Reproducibilidad
= 0,035 (desviación estándar a partir de 5 réplicas)
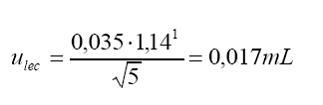
1
estadístico t para 4 grados de libertad y 68% de confianza.
Incertidumbre
estándar por diferencia entre la temperatura de calibración (20 °C) y la
temperatura
de trabajo:
Variación
máxima de temperatura alrededor de 20 °C = .3 °C
Coeficiente
de expansión térmica del agua = 2,1.10-4 °C-1
Distribu ción = rectangular
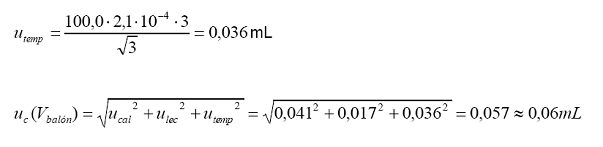
Cálculo
de incertidumbre:
 Reporte
del resultado:
Reporte
del resultado:
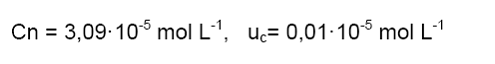
Ejemplo
6: Determinación de la concentración promedio de cierto componente x en un
alimento mediante la técnica de espectrofotometría ultravioleta. Luego de
seguir el procedimiento indicado, el cálculo de la concentración del
componente x se obtiene según la fórmula:
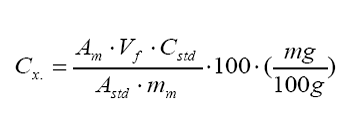
En
términos de la absorbancia, masa y volumen final de la muestra.
Los
resultados obtenidos para tres muestras del alimento se indican en la siguiente
tabla:
|
#
muestra |
mm/g
|
Am
|
|
1 |
25,2356
|
0,385
|
|
2 |
27,4578
|
0,421
|
|
3 |
26,1167
|
0,393
|
1.
Cálculo de concentración y análisis de incertidumbre para la muestra #1:
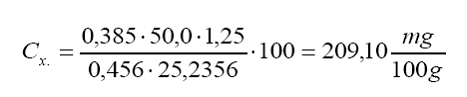
Am
= absorbancia de la muestra.
Am
= 0,385.
Contribuciones
a la incertidumbre calculadas como de costumbre:

Astd
= absorbancia del estándar.
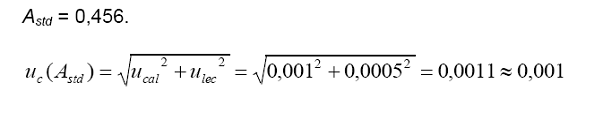
Cstd
= concentración del estándar del componente x, preparado a partir de un estándar
sólido certificado según se
indica:
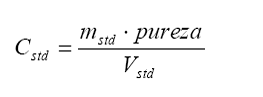
donde
mstd es la masa del estándar sólido de cierta pureza reportada, la
cual ha sido disuelta hasta un volumen final Vstd:
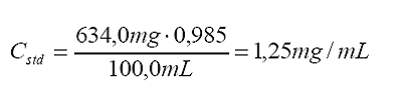
contribuciones
de incertidumbre calculadas como de costumbre:
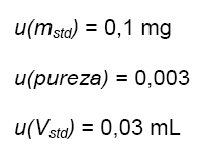

Vf
= volumen final de la muestra (balón aforado).
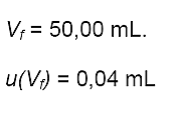
mm
= masa de la muestra.
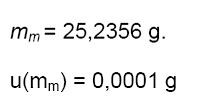
Cálculo
de incertidumbre:
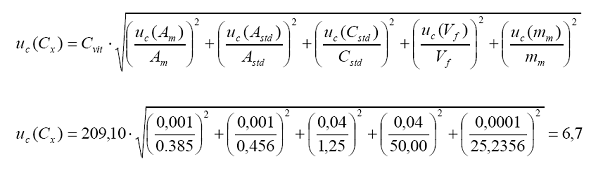
2.
Cálculo e incertidumbre de la concentración promedio del componente x:
Un
procedimiento de cálculo similar aplicado a las otras dos muestras permite
obtener los resultados resumidos en la siguiente tabla:
|
#
muestra |
|
|
|
1 |
209,1
|
6,7
|
|
2 |
210,2
|
6,7
|
|
3 |
206,2
|
6,6
|
De
donde se obtiene el valor de la concentración promedio con su respectiva
incertidumbre estándar:
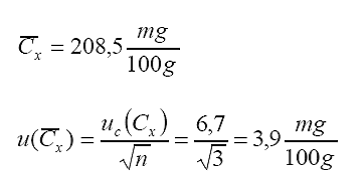
Para
completar el cálculo de incertidumbre del valor promedio se debe de tomar en
cuenta la contribución por repetibilidad. Esta se calcula en términos del desvío
estándar de las réplicas respecto del valor promedio:
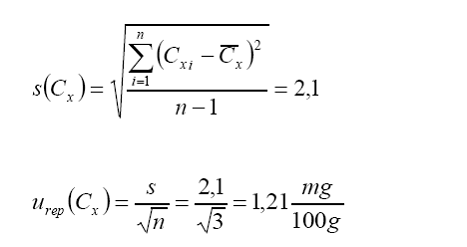
Ahora
el cálculo de la incertidumbre estándar combinada total del valor promedio será
ahora:
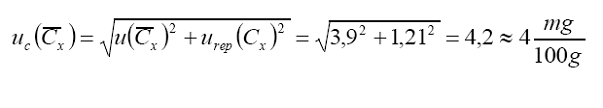
Reporte
de resultado:
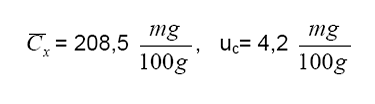
incertidumbre
expandida a un 95% de confianza =
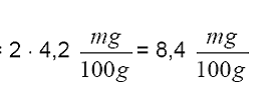
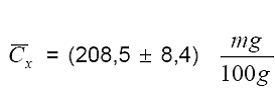 =
con un factor de cobertura k=2, que indica un nivel de confianza de
aproximadamente el 95 %.
=
con un factor de cobertura k=2, que indica un nivel de confianza de
aproximadamente el 95 %.